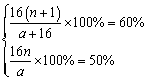题目内容
元素R可以组成两种氧化物ROm和ROn,其相对分子质量之差为16,ROm中氧元素的质量分数为60%、ROn中氧元素的质量分数为50%,试推断R是何种元素,写出它的两种氧化物的化学式。
答案:
解析:
提示:
解析:
| 解:由ROm和ROn二者的相对分子质量相差16可知,一个ROm分子比一个ROn分子多一个氧原子,即m=n+1。
设ROn的相对分子质量为a,ROm的相对分子质量为(a+16)。根据ROn中氧元素的质量分数为50%可知ROn中氧元素的总量为0.5a,ROm中氧元素的总量为(0.5a+16)。列方程组:
则R的相对原子质量为64´(1-50%)=32。因此,R的元素符号为S,是硫元素,ROn为SO2,ROm为SO3。
|
提示:

练习册系列答案
相关题目