题目内容
【题目】如图是四种物质的溶解度曲线。下列说法错误的是
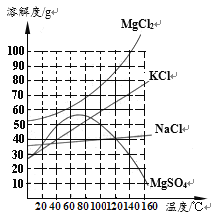
A.80℃时,溶解度关系是MgCl2>MgSO4>KCl>NaCl
B.60℃时,KCl饱和溶液的质量分数约为46%
C.分离含少量NaCl 的MgCl2溶液,采用先蒸发浓缩,再降温结晶的方法
D.将70℃时MgCl2和MgSO4的饱和溶液升温到100℃时,有晶体析出的是MgSO4
【答案】B
【解析】
A、由图可知,80℃时,溶解度关系是MgCl2>MgSO4>KCl>NaCl,不符合题意;
B、由图可知,60℃时,KCl的溶解度约为46g,故该温度下,氯化钾饱和溶液的质量分数约为![]() ,符合题意;
,符合题意;
C、氯化钠、氯化镁的溶解度都随温度的升高而增加,氯化钠的溶解度受温度的影响较小,氯化镁的溶解度受温度的影响较大,故分离含少量NaCl 的MgCl2溶液,采用先蒸发浓缩,再降温结晶的方法,不符合题意;
D、从70℃~100℃,氯化镁的溶解度随温度的升高而增加,硫酸镁的溶解度随温度的升高而减小,故将70℃时MgCl2和MgSO4的饱和溶液升温到100℃时,氯化镁变为不饱和溶液,硫酸镁有晶体析出,还是饱和溶液,不符合题意。
故选B。

【题目】已知白磷的着火点为40℃,某化学兴趣小组为探究可燃物的燃烧条件,设计并进行了如下实验(实验过程中长颈漏斗下端始终在液面以下;注射器的摩擦力忽略不计):
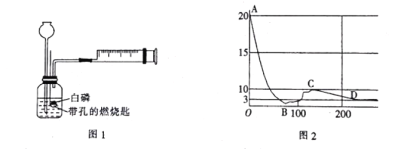
(1)实验前需要检验装置的气密性,写出检验该装置气密性的方法:______________。
(2)写出白磷燃烧的化学方程式:__________________________。
实验步骤 | 实验现象 |
①将白磷放在燃烧匙内,塞好胶塞 | |
②从长颈漏斗向瓶内迅速注入60℃的水至刚刚浸没白磷 | 白磷没燃烧 |
③连接好注射器,向瓶内推入空气,瓶内水面下降,停止推入空气 | 白磷燃烧,有白烟产生 |
④白磷熄灭后,瓶内水面上升,最后淹没白磷 | 白磷熄灭 |
(3)对比步骤②和③可知,可燃物燃烧条件之一是___________________,若把60℃的水换成20℃的水,重复实验步骤②和③,对比两次实验现象,还可以得出可燃物燃烧需要满足的条件是_______________。
(4)步骤④中瓶内液面上升,原因是____________________。
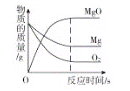
(实验拓展)用仪器测定白磷燃烧时集气瓶内氧气体积分数的变化,结果如图2所示[横坐标为反应时间(s),纵坐标为密闭容器中氧气的体积分数(%)]。
(5)通过分析数据,你对燃烧需要氧气有什么新的认识:___________________。
(6)分析图2中曲线变化趋势可知,在___________________(填字母)点时白磷全部熄灭。请解释曲线AB段、BC段、CD段的变化原因:
AB段:____________________________________________。
BC段:____________________________________________。
CD段:____________________________________________。