��Ŀ����
����Ŀ��ij��ѧ��ȤС���һ������ĺ�ɫ��ĩ��ɽ���̽����������벢�ش����⣮
����Cu��Fe2O3���ֹ����е�һ�ֻ�������ɣ�
��ɫ��ĩ���ܵ���ɣ�
����٣�ֻ��Cu������ڣ�ֻ��Fe2O3������ۣ���Cu��Fe2O3�Ļ����
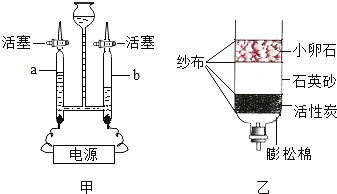
ͬѧ��Ϊȷ����ɫ��ĩ����ɣ���ȡ�÷�ĩ5.0gװ��Ӳ�ʲ������У�����ͼ1��ͨ����н���ʵ�飮
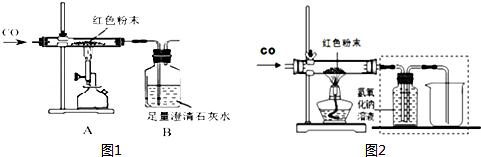
��1��ʵ�鿪ʼʱҪ��ͨһ��ʱ��CO��Ȼ���ټ��ȣ�Ŀ���� ������Ӧ��ȫ��ֹͣ���ȣ�����ͨCO����ֱ����������ȴ��
��2����Ӧǰ��������װ�ú����ʵ������������������±���
��Ӧǰ | ��Ӧ�� |
�����ܺͺ�ɫ��ĩ��������Ϊ37.3g | �����ܺ������ʵ�������Ϊ36.1g |
Aװ���з�����Ӧ�Ļ�ѧ����ʽ ��С��ͬѧ�������е����ݺ���Ϊ����۳��������ɫ��ĩ�и��ɷֵ�������Ϊ ����д��������̣�
��3��С��ͬѧ��ΪΪ�˷�ֹ��Һ������ֹͣ����ǰӦ�ȶϿ�A��B�����ӣ�����Ϊ�Ƿ���Ҫ ��Ϊʲô�� ��
�ӻ����ĽǶȿ�����װ�ô��ڵ�ȱ���� ����ĸĽ������� ����ͬѧ���������ͼ2װ�ô���ԭװ�ã�ʵ��װ��ͼ�в������߿��ڵ�װ�ã��������У������ն�����̼���� ��
���𰸡���1���ž��������ڿ�������ֹ����ʱ������ը��
��2��3CO+Fe2O3![]() 2Fe+3CO2��4��1��
2Fe+3CO2��4��1��
��3������Ҫ��ʵ�������һֱ��ͨCO���壬������������û��β������װ�ã���Bװ�ú���ĵ��ܿڷ�һ��ȼ�ŵľƾ��ƣ��ռ�CO���壮
����������1��ʵ�鿪ʼʱҪ��ͨһ��ʱ��CO��Ȼ���ټ��ȣ�Ŀ�����ž��������ڿ�������ֹ����ʱ������ը������ž��������ڿ�������ֹ����ʱ������ը��
��2��Aװ���У���������һ����̼��Ӧ�������Ͷ�����̼��������Ӧ�Ļ�ѧ����ʽΪ��3CO+Fe2O3![]() 2Fe+3CO2��
2Fe+3CO2��
�⣺������ͱ������ݿ�֪������������Ԫ�ص�����Ϊ��37.3g��36.1g=1.2g��
������������������Ϊ��1.2g�£�![]() ��100%��=4g��
��100%��=4g��
��ͭ������Ϊ��5g��4g=1g��
���ɫ��ĩ����������ͭ��������Ϊ��4g��1g=4��1��
��3����ʵ�������һֱͨCO���壬����������������ֹͣ����ǰ����Ҫ�ȶϿ�A��B�����ӣ�
�ӻ����ĽǶȿ�����װ�ô��ڵ�ȱ����û��β������װ�ã��Ľ���������Bװ�ú���ĵ��ܿڷ�һ��ȼ�ŵľƾ��ƣ���һ����̼ת���ɶ�����̼��
��ͬѧ���������ͼ2װ�ô���ԭװ�ã�ʵ��װ��ͼ�в������߿��ڵ�װ�ã��������У������ն�����̼�����ռ�CO���壮

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�