题目内容
某胃药中含有氢氧化镁,如每片药品中含氢氧化镁0.29克.取该药品四片,与7.3克的盐酸恰好完全反应.
求:
①每片药品中氢氧化镁物质的量;
②反应消耗盐酸的质量分数.
解:①已知每片药品中含氢氧化镁0.29克,Mg(OH)2的相对分子质量=24+(16+1)×2=58,则每片药品中氢氧化镁物质的量=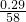 =0.005mol
=0.005mol
②解:设盐酸中HCl的物质的量为xmol
nMg(OH)2=0.005mol×4=0.02 mol
Mg(OH)2+2HCl═MgCl2+2H2O
1 2
0.02 x
x=0.04mol
反应消耗盐酸的质量分数=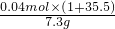 ×100%=20%
×100%=20%
答:反应消耗盐酸的质量分数为20%.
分析:①根据公式:物质的量=物质的质量/物质的相对分子质量进行计算;
②根据氢氧化镁和盐酸反应的化学方程式以及参加反应的物质的量进行计算.
点评:熟悉物质的量的计算公式,利用化学方程式进行计算时一定要正确书写化学方程式.
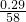 =0.005mol
=0.005mol②解:设盐酸中HCl的物质的量为xmol
nMg(OH)2=0.005mol×4=0.02 mol
Mg(OH)2+2HCl═MgCl2+2H2O
1 2
0.02 x
x=0.04mol
反应消耗盐酸的质量分数=
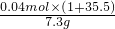 ×100%=20%
×100%=20%答:反应消耗盐酸的质量分数为20%.
分析:①根据公式:物质的量=物质的质量/物质的相对分子质量进行计算;
②根据氢氧化镁和盐酸反应的化学方程式以及参加反应的物质的量进行计算.
点评:熟悉物质的量的计算公式,利用化学方程式进行计算时一定要正确书写化学方程式.

练习册系列答案
相关题目