题目内容
其变质程度如何呢?
〔提出猜想〕小明猜想:这五瓶NaOH溶液可能全部变质了,也可能
通过查资料,小明知道:CaCl2溶液和Na2CO3溶液发生复分解反应.
〔实验探究〕小明设计如下实验来验证自己的猜想,请根据表中内容填写表中有横线的格.
〔拓展应用〕保存NaOH溶液的方法是
(实验探究)由于碳酸钠溶液呈碱性,影响使用酚酞对氢氧化钠的检验,因此首先使用足量氯化钙等物质,充分反应沉淀掉溶液中的碳酸钠且不形成碱性物质,然后滴加酚酞检验溶液中的氢氧化钠;由于碳酸钠与少量稀盐酸反应放出的二氧化碳会被溶液中氢氧化钠吸收而观察不到产生气泡,因此,可采取滴入足量稀盐酸,观察先无气泡而后出现气泡的现象证明氢氧化钠部分变质;
(拓展应用)氢氧化钠能吸收空气中二氧化碳,应密封保存.
故答案为:CO2+2NaOH═Na2CO3+H2O;
(提出猜想)氢氧化钠溶液吸收空气中二氧化碳气体,生成碳酸钠而变质的情况有以下两种:一是全部形成碳酸钠而全部变质,二是只有部分形成碳酸钠而部分变质;
故答案为:部分变质;
氢氧化钠与碳酸钠都能使无色酚酞变红,因此,在使用酚酞检验氢氧化钠是否存在前应使用足量氯化钙把溶液中碳酸钠完全沉淀;如果使用稀盐酸滴入,由于稀盐酸能与碳酸钠反应放出二氧化碳,观察到气泡可判断含有碳酸钠,如果没看到气泡,却可能是由于所加盐酸量不足而造成先与溶液中氢氧化钠反应的实验现象,根据这一现象可判断氢氧化钠变质程度;
故答案为:
| 实验步骤 | 现象 | 结论 |
| 不能确定变质的程度 | ||
| 不能确定变质的程度 | ||
| 白色沉淀、加酚酞不变色 | ||
| 不能确定变质的程度 | ||
| 开始无现象,后来有气泡 |
故答案为:密封保存.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案(8分)小明来到实验室时,发现实验桌上有五瓶敞口放置的NaOH溶液,他想这五瓶NaOH溶液一定变质了。请你用方程式表示变质的原理: 。
其变质程度如何呢?
【提出猜想】小明猜想:这五瓶NaOH溶液可能全部变质了,也可能 。
通过查资料,小明知道:CaCl2溶液和Na2CO3溶液发生复分解反应。
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写表中有横线的格。
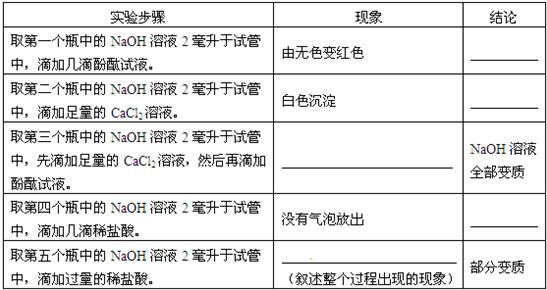
|
实验步骤 |
现象 |
结论 |
|
取第一个瓶中的NaOH溶液2毫升于试管中,滴加几滴酚酞试液。 |
由无色变红色 |
|
|
取第二个瓶中的NaOH溶液2毫升于试管中,滴加足量的CaCl2溶液。 |
白色沉淀 |
|
|
取第三个瓶中的NaOH溶液2毫升于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
|
NaOH溶液全部变质 |
|
取第四个瓶中的NaOH溶液2毫升于试管中,滴加几滴稀盐酸。 |
没有气泡放出 |
|
|
取第五个瓶中的NaOH溶液2毫升于试管中,滴加过量的稀盐酸。 |
(叙述整个过程出现的现象) |
部分变质 |
【拓展应用】保存NaOH溶液的方法是 。
小明来到实验室时,发现实验桌上有五瓶敞口放置的NaOH溶液,他想这五瓶NaOH溶液一定变质了。请你用方程式表示变质的原理: 。
其变质程度如何呢?
【提出猜想】小明猜想:这五瓶NaOH溶液可能全部变质了,也可能 。
通过查资料,小明知道:CaCl2溶液和Na2CO3溶液发生复分解反应。
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写表中有横线的格。
| 实验步骤 | 现象 | 结论 |
| 取第一个瓶中的NaOH溶液2毫升于试管中,滴加几滴酚酞试液。 | 由无色变红色 |
|
| 取第二个瓶中的NaOH溶液2毫升于试管中,滴加足量的CaCl2溶液。 | 白色沉淀 |
|
| 取第三个瓶中的NaOH溶液2毫升于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
| NaOH溶液全部变质 |
| 取第四个瓶中的NaOH溶液2毫升于试管中,滴加几滴稀盐酸。 | 没有气泡放出 |
|
| 取第五个瓶中的NaOH溶液2毫升于试管中,滴加过量的稀盐酸。 | (叙述整个过程出现的现象) | 部分变质 |
【拓展应用】保存NaOH溶液的方法是 。
其变质程度如何呢?
〔提出猜想〕小明猜想:这五瓶NaOH溶液可能全部变质了,也可能______.
通过查资料,小明知道:CaCl2溶液和Na2CO3溶液发生复分解反应.
〔实验探究〕小明设计如下实验来验证自己的猜想,请根据表中内容填写表中有横线的格.
| 实验步骤 | 现象 | 结论 |
| 取第一个瓶中的NaOH溶液2毫升于试管中,滴加几滴酚酞试液. | 有无色变红色 | ___________________ |
| 取第二个瓶中的NaOH溶液2毫升于试管中,滴加足量的CaCl2溶液. | 白色沉淀 | ___________________ |
| 取第三个瓶中的NaOH溶液2毫升于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | ________________________ | NaOH溶液 全部变质 |
| 取第四个瓶中的NaOH溶液2毫升于试管中,滴加几滴稀盐酸. | 没有气泡放出 | ___________________ |
| 取第五个瓶中的NaOH溶液2毫升于试管中,滴加过量的稀盐酸. | _______________________ (叙述整个过程出现的现象) | 部分变质 |