题目内容
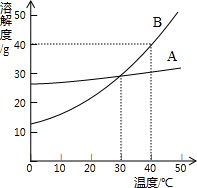 图是A、B两种固体物质的溶解度曲线,据图回答下列问题:
图是A、B两种固体物质的溶解度曲线,据图回答下列问题:(1)10℃时,A、B两种物质的溶解度由大到小的顺序为
(2)30℃时,将10g B物质加入50g水中充分溶解,所形成溶液的质量为
(3)若使A物质从它的饱和溶液中大量析出,最适宜的方法是
(4)40℃时,B物质饱和溶液中溶质的质量分数是
分析:弄清固体溶解度的概念:在一定温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量,理解固体溶解度曲线的意义:①某固体物质在某温度下的溶解度,②在同一温度下,比较不同物质的溶解度大小,③固体物质的溶解度随温度变化的变化情况等.
解答:解:(1)由两物质的溶解度曲线可知,在10℃时,A的溶解度大于B的溶解度,故答案为:A>B
(2)由B的溶解度曲线可知,在30℃时,B的溶解度大约是28克,即在100克水中最多溶解28克B,则在50克水中最多溶解14克B,所以30℃时,将10g B物质加入50g水中充分溶解,这10克B会全部溶解,则得到的溶液是60克,故答案为:60
(3)由于A的溶解度受温度的影响很小,因此若使A物质从它的饱和溶液中大量析出,应采取蒸发结晶的方法,故答案为:蒸发
(4)由于在40℃时,B的溶解度是40克,即在100克水中最多溶解40克B,则形成的饱和溶液中溶质的质量分数为
×100%=28.6%,故答案为:28.6%
(2)由B的溶解度曲线可知,在30℃时,B的溶解度大约是28克,即在100克水中最多溶解28克B,则在50克水中最多溶解14克B,所以30℃时,将10g B物质加入50g水中充分溶解,这10克B会全部溶解,则得到的溶液是60克,故答案为:60
(3)由于A的溶解度受温度的影响很小,因此若使A物质从它的饱和溶液中大量析出,应采取蒸发结晶的方法,故答案为:蒸发
(4)由于在40℃时,B的溶解度是40克,即在100克水中最多溶解40克B,则形成的饱和溶液中溶质的质量分数为
| 40g |
| 100g+40g |
点评:本题难度不大,主要考查了对固体溶解度概念的理解及固体的溶解度和同温度下饱和溶液中溶质的质量分数间的关系,根据固体的溶解度曲线来解决有关的问题,培养学生分析问题、理解问题、解决问题的能力.

练习册系列答案
相关题目
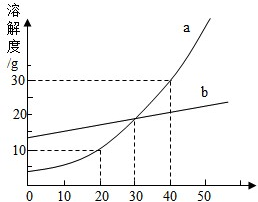 (2012?杨浦区二模)如图是a、b两种固体物质的溶解度曲线.
(2012?杨浦区二模)如图是a、b两种固体物质的溶解度曲线. (2005?西城区二模)如图是a、b两种固体物
(2005?西城区二模)如图是a、b两种固体物 如图是a、b两种固体物________.
如图是a、b两种固体物________.