题目内容
【题目】根据下列装置图填写有关空格:
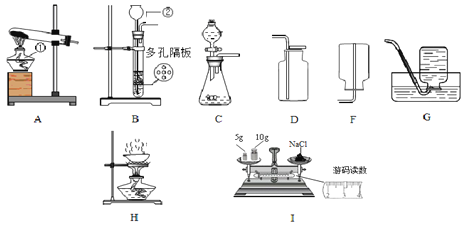
(1)仪器②的名称为___________。
(2)实验室制取二氧化碳的化学方程式为______________________,制取该气体的发生装置可选用上述_______(填序号)装置;收集二氧化碳可用 _____(填序号)装置。
(3)实验室用A装置制取氧气的化学方程式为____________________________。
(4)用氯化钠固体和水配制10%的氯化钠溶液,实验步骤是______、称量、溶解、装瓶,配制结束后发现是使用I图方法进行称量的,其他操作均规范,则所得溶液中氯化钠的质量分数为_______。(保留小数点后一位)
(5)除去粗盐中不溶性杂质的实验步骤是溶解、过滤和蒸发结晶,蒸发时用到的装置是H,该装置有一处明显的错误是__________________。
【答案】 长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ BC D 2KClO3![]() 2KCl + 3O2↑ 计算 6.5% 没有用玻璃棒搅拌
2KCl + 3O2↑ 计算 6.5% 没有用玻璃棒搅拌
【解析】(1). 长颈漏斗 (2).实验室常用石灰石和盐酸反应生成氯化钙、二氧化碳、水,反应方程式为: CaCO3+2HCl=CaCl2+H2O+CO2↑ (3). 制取二氧化碳应使用固液常温型发生装置B或C;二氧化碳的密度比空气的大,能溶于水,应该用向上排空气法收集; (4). 氯酸钾法制氧气,应该用加热固体制取气体的装置A ; (5).氯酸钾在二氧化锰的作用下受热分解生成氯化钾、氧气;反应方程式为: 2KClO3![]() 2KCl + 3O2↑ (6). 配制一定质量溶质质量分数的溶液的步骤是:计算、称量、溶解、装瓶存放 ;(7).称量固体时,砝码和物反放时,物的质量是砝码量-游码,15g-3g=12g;由图中数值可知,原打算配制溶液的质量是180g,需要水的质量为168g,所得溶液中氯化钠的质量分数12g÷(12g+168g)×100%= 6.5% (8). 蒸发时要用玻璃棒搅拌,使液体受热均匀,防止液体飞溅。
2KCl + 3O2↑ (6). 配制一定质量溶质质量分数的溶液的步骤是:计算、称量、溶解、装瓶存放 ;(7).称量固体时,砝码和物反放时,物的质量是砝码量-游码,15g-3g=12g;由图中数值可知,原打算配制溶液的质量是180g,需要水的质量为168g,所得溶液中氯化钠的质量分数12g÷(12g+168g)×100%= 6.5% (8). 蒸发时要用玻璃棒搅拌,使液体受热均匀,防止液体飞溅。

【题目】在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
物质 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 50 | 1 | 1 | 23 |
反应后质量/g | 2 | 45 | 28 | x |
A. 根据质量守恒定律,x的值应为0
B. 反应后的生成物是二氧化碳和水
C. 物质W只含碳和氢两种元素
D. 物质W一定含碳、氢、氧三种元素