题目内容
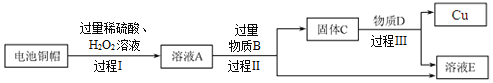
【题目】A﹣H都是初中化学常见物质.其中A、B的组成元素相同,且常温下都是无色液体;H是蓝色沉淀.X、Y都是氧化物,其中X是黑色粉末状固体,Y常用作食品干燥剂,Z是红色固体.它们之间有如图转化关系.
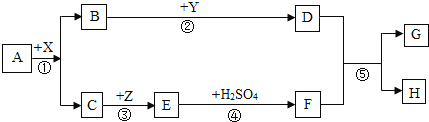
根据上述信息,回答下列问题:
(1)写出A的化学式为 __________;H的化学式________;D的水溶液俗称 __________ 。
(2)反应⑤的化学方程式____________________,属于_________反应。(填基本类型)
(3)反应①中X起______作用。Z的一种用途是______________________。
【答案】H2O2 Cu(OH)2 石灰水 Ca(OH)2 +CuSO4 = Cu(OH)2↓+CaSO4 复分解 催化 制作电线
【解析】
A、B的组成元素相同,且常温下都是无色液体,A→B,则A是H2O2,B是H2O,X是黑色粉末状固体,X是MnO2,在此反应中起催化作用,C是O2。Y常用作食品干燥剂,则Y是CaO,CaO+H2O=Ca(OH)2,D是Ca(OH)2。H是蓝色沉淀,则H是Cu(OH)2。Z是红色固体,则Z是Cu,2Cu+O2![]() 2CuO,CuO+H2SO4=CuSO4+H2O,F是CuSO4,Ca(OH)2+CuSO4 = Cu(OH)2↓+CaSO4,G是CaSO4。
2CuO,CuO+H2SO4=CuSO4+H2O,F是CuSO4,Ca(OH)2+CuSO4 = Cu(OH)2↓+CaSO4,G是CaSO4。
(1)A的化学式为 H2O2;H的化学式为Cu(OH)2;D的水溶液是氢氧化钙溶液,俗称石灰水 。
(2)反应⑤的化学方程式为:Ca(OH)2 +CuSO4 = Cu(OH)2↓+CaSO4,由两种化合物互相交换成分生成另外两种化合物的反应是复分解反应。
(3)反应①中X是MnO2,在此反应中起催化作用。铜具有良好的的导电性,可制作电线。

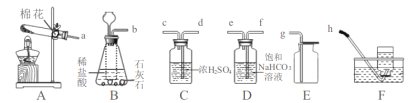
【题目】根据资料报道,世界上每年因锈蚀而报废的金属设备和材料相当于年产量的20%~40%,某实验小组对铁的锈蚀进行了如下探究.如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
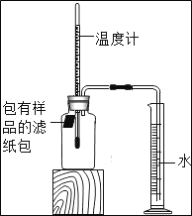
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
① | 1g铁粉、0.2g碳和十滴水 | 100 | 72 | 约120 |
② | 1g铁粉、0.2g碳、十滴水和少量NaCl | 100 | 72 | 约70 |
③ | _____ | / | / | / |
(1)金属腐蚀的过程实际上就是金属元素化合价_____(填“升高”或“降低”)的过程.
(2)实验①和②说明NaCl可以_____(填“加快”或“减慢”)铁锈蚀的速率.
(3)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程.
(4)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____.
(5)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____.
(6)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____%(精确到0.1%).试分析该实验结果出现误差的原因:_____(写出任意一条即可).
【题目】某同学为了研究在实验室中用某氯酸钾样品制取氧气的有关问题,他将5g氯酸钾样品与1g二氧化锰混合加热,在不同时刻测得部分数据如下表(友情提示:可把表中的空白补全后作答)。
加热时间 | t1 | t 2 | t3 | t4 |
剩余固体质量/g | 5.04 | 4.08 | ||
生成O2质量/g | 1.84 | 1.92 |
回答:
(1)t3时刻后,氯酸钾是否已经完全反应?_____。
(2)该样品中氯酸钾的质量分数_____。
(3)求t1时刻原氯酸钾中已分解的氯酸钾的质量分数____(写出解题过程)。