题目内容
(6分)收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2。A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯。B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸。小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3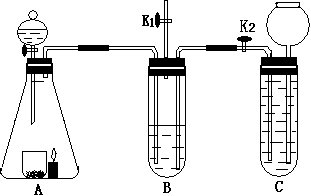
(1)K1是打开的,K2是关闭的。打开A中分液漏斗的开关放下足够多的液体,发现蜡烛燃烧的更旺。B中的现象是(足够长的时间)_________;用三个化学方程式表示B中发生化学变化的原因______、______、_____。
(2)接着关闭K1,打开K2。B中的现象______________;C中的现象(B、C间的导管提前充满水)___________。
(3)C中的气体即为蜡烛燃烧产生的部分纯净的CO2。
(1)有气泡放出,红色褪去;
CO2 + 2 NaOH = Na2CO3 + H2O、Na2CO3 + CO2+ H2O = 2NaHCO3、CO2 + H2O= H2CO3。
(2)B中左侧导管继续冒气泡;试管中液面下降;
C中左侧导管处出口有气泡生成,液面下降,分液漏斗中液面上升。
解析试题分析:(1)蜡烛燃烧的更旺,说明A中生成了氧气;由于锥形瓶内有燃着的足量的蜡烛,故同时燃烧生成的二氧化碳就会较多,所以B中左边的导气管口会因二氧化碳的导出而产生气泡;二氧化碳进入B,会与水反应生成碳酸(CO2+H2O=H2CO3),与氢氧化钠反应生成碳酸钠和水(CO2+2NaOH=Na2CO3+H2O),还能与碳酸钠反应生成NaHCO3(Na2CO3+CO2+H2O=2NaHCO3),故最终会消耗掉碱性物质,溶液的碱性会消失,酚酞的红色会褪去。
(2)接着关闭K1,打开K2,B中由于气体二氧化碳的聚集而导致其内压强变大,液体会被压入C中,故可见B中左侧导管口继续冒气泡,同时试管中的液面会下降;而C中的液体压强也随之变大,故导致分液漏斗中液体上升。
考点:碱的化学性质,二氧化碳的化学性质,酸的化学性质,书写化学方程式
点评:此题是一道实验设计考查题,解题的关键是认识其中的反应,结合压强知识进行现象的判断,属于综合性实验题。

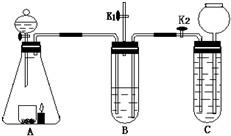 32、收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3
32、收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3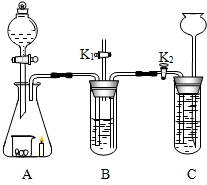 收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3
收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3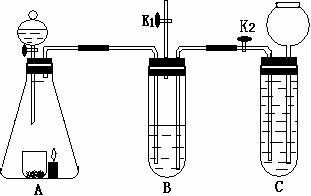
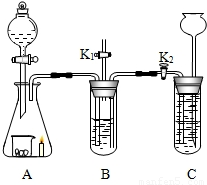 (2011?门头沟区一模)收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3
(2011?门头沟区一模)收集蜡烛燃烧产生的CO2往往混有很多杂质,化学小组的同学设计了下图装置收集纯净的CO2.A中分液漏斗盛有足量液体,锥形瓶内有燃着的足量的蜡烛和盛有黑色粉末的烧杯.B中试管装有滴加酚酞的氢氧化钠溶液;C中试管装有盐酸.小组同学查资料得知CO2与Na2CO3溶液也能反应生成NaHCO3