题目内容
已知海水中含有氯化镁,但因其含量低而不能用于生产镁.某工厂利用海水和海边丰富的贝壳(主要成分是CaCO3)资源来制取氢氧化镁,然后制取较纯净的氯化镁,并再用于生产镁.写出制取氯化镁的有关反应的化学方程式________.
CaCO3 CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O
CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O
分析:利用碳酸钙分解得到氧化钙,然后利用氧化钙转化为氢氧化钙,再使氢氧化钙与氯化镁反应得到氢氧化镁,最后利用氢氧化镁与盐酸反应即得到氯化镁.
解答:将贝壳在高温下锻烧,碳酸钙分解生成氧化钙和二氧化碳,再将氧化钙与水反应得到氢氧化钙,氢氧化钙与海水中氯化镁反应生成氢氧化镁沉淀和氯化钙,过滤出沉淀氢氧化镁与稀盐酸反应,生成氯化镁和水;
故答案为:CaCO3 CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O.
CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O.
点评:根据各物质的性质及转化规律,利用复分解反应的变化规律,对相关转化的推断.
 CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O
CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O分析:利用碳酸钙分解得到氧化钙,然后利用氧化钙转化为氢氧化钙,再使氢氧化钙与氯化镁反应得到氢氧化镁,最后利用氢氧化镁与盐酸反应即得到氯化镁.
解答:将贝壳在高温下锻烧,碳酸钙分解生成氧化钙和二氧化碳,再将氧化钙与水反应得到氢氧化钙,氢氧化钙与海水中氯化镁反应生成氢氧化镁沉淀和氯化钙,过滤出沉淀氢氧化镁与稀盐酸反应,生成氯化镁和水;
故答案为:CaCO3
 CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O.
CaO+CO2↑,CaO+H2O═Ca(OH)2,Ca(OH)2+MgCl2═Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl═MgCl2+2H2O.点评:根据各物质的性质及转化规律,利用复分解反应的变化规律,对相关转化的推断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
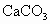 )资源来制取氢氧化镁,然后制取较纯净的氯化镁,并电解熔融的氯化镁制取镁.写出有关反应的化学方程式.说出本题中没有涉及的化学基本反应类型.
)资源来制取氢氧化镁,然后制取较纯净的氯化镁,并电解熔融的氯化镁制取镁.写出有关反应的化学方程式.说出本题中没有涉及的化学基本反应类型.