题目内容
【题目】已知Na2O2为淡黄色粉末,常温下可与H2O剧烈反应,化学方程式为2Na2O2+2H2O═4NaOH+O2↑,因此Na2O2可用于制取O2 .
根据以上信息回答下列问题:
(1)Na2O2中氧元素的化合价为 .
(2)若用Na2O2与H2O反应制取O2 , 可以选用图中哪个发生装置 . 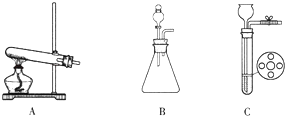
若用同样装置还可选用、物质(填化学式)制取O2 , 写出该反应的化学方程式 .
【答案】
(1)﹣1
(2)B;过氧化氢;二氧化锰;2H2O2![]() 2H2O+O2↑
2H2O+O2↑
【解析】解:(1)钠元素显+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x=0,则x=﹣1价;故填:﹣1.(2)固体过氧化钠与水制取氧气的反应物是固体和液体,反应条件是常温,所以可选用B装置作气体发生装置;若用同样装置还可选用过氧化氢以二氧化锰为催化剂制取O2 , 该反应的化学方程式为:2H2O2![]() 2H2O+O2↑;故填:B;过氧化氢;二氧化锰;2H2O2
2H2O+O2↑;故填:B;过氧化氢;二氧化锰;2H2O2![]() 2H2O+O2↑.
2H2O+O2↑.
【考点精析】利用氧气的制取装置和氧气的收集方法对题目进行判断即可得到答案,需要熟知发生装置:固固加热型、固液不加热型;收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部.

练习册系列答案
相关题目
