题目内容
【题目】KNO3与KCl的溶解度曲线如图所示,请回答下列问题:
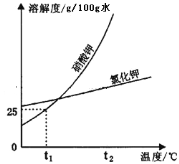
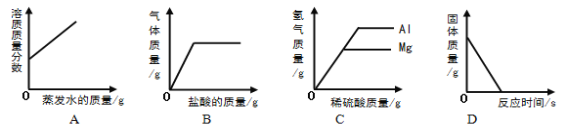
①t2℃时,KNO3的溶解度 (9) KCl的溶解度(填“>”、“<”或“=”)。
②t1℃时,将50g KNO3加入 (10) g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是 (11) 。
③KNO3溶液中含有少量KCl时,可通过 (12) 的方法提纯。
④实验室可用化学方法来鉴别KNO3与KCl溶液,请用化学方程式表示其原理 (13) 。
⑤在一定温度下,向100克水中依次加入一定质量的KCl固体,充分溶解,所加KCl的质量与得到相应溶液的质量关系如下图所示:
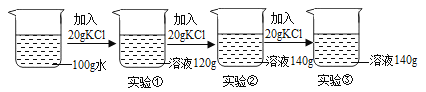
Ⅰ.实验②的溶液是否为饱和溶液? (14) (填“是”、“不是”或“无法判断”)。
Ⅱ.实验①、②、③所得溶液的溶质质量分数分别表示为a%、b%、c%,则a、b、c的大小关系是 (15) (用“>”、“<”或“=”表示)。
【答案】①>
②200 升高温度后再加溶质
③降温结晶
④KCl+AgNO3==AgCl↓+KNO3
⑤Ⅰ、是 Ⅱ、a<b=c
【解析】
试题分析:①根据溶解度曲线,t2℃时,KNO3的溶解度>KCl的溶解度
②根据溶解度曲线,t1℃时,KNO3的溶解度为25g,表示在100g水中最多只能溶解25g KNO3,故将50g KNO3加入200 g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是:升高温度后再加溶质或蒸发水分后升温
③根据溶解度曲线,KNO3的溶解度随温度变化的趋势比KCl的溶解度随温度变化的趋势要更大,故KNO3溶液中含有少量KCl时,可通过降温结晶的方法提纯
④鉴别KNO3与KCl溶液,采用硝酸银溶液,有白色沉淀生成的为KCl溶液,化学反应方程式为:KCl+AgNO3==AgCl↓+KNO3
⑤Ⅰ、根据实验②的溶液质量为140g,再加入20gKCl固体,溶液质量仍然为140g,说明溶液不能再溶解溶质,故实验②的溶液是为饱和溶液
Ⅱ、实验②、③所得溶液为同温下的饱和溶液,故溶质质量分数相等,而实验①所得溶液为该温下的不饱和溶液,故溶质质量分数最小,所以a、b、c的大小关系是a<b=c

 阅读快车系列答案
阅读快车系列答案