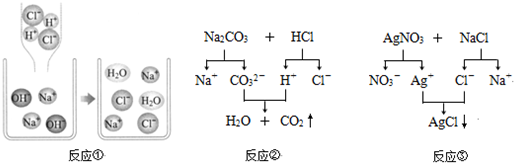
题目内容
氢氧化钠稀溶液与稀盐酸混合后虽然没有明显变化,但确实发生了化学反应.请你完成关于上述反应的实验研究的有关问题.
(1)方案一:测定稀盐酸与氢氧化钠稀溶液混合前后的pH(20℃)
测定某氢氧化钠稀溶液的pH,pH
将一定量的稀盐酸加入该氢氧化钠稀溶液,混合均匀后测定溶液的pH,pH<7;
结论:稀盐酸与氢氧化钠稀溶液发生了化学反应,并且
(2)方案二:①向一小烧杯中加入约10mL稀氢氧化钠溶液,滴加2~3滴酚酞试液;②用胶头滴管吸取稀盐酸逐滴加入上述小烧杯中,边滴边用玻璃棒轻轻搅拌,当溶液刚好变成
(3)上述两个方案在设计思想上的共同点是
(4)在实施方案二时,为了检验稀盐酸是否恰好与氢氧化钠溶液完全反应,采用以下方法证明:取实验②反应后的溶液少许于试管中,再滴加1滴氢氧化钠稀溶液,溶液的颜色变为红色即可证明.该方法是否严密?
(1)方案一:测定稀盐酸与氢氧化钠稀溶液混合前后的pH(20℃)
测定某氢氧化钠稀溶液的pH,pH
>
>
7(选填“>”、“<”或“=”):将一定量的稀盐酸加入该氢氧化钠稀溶液,混合均匀后测定溶液的pH,pH<7;
结论:稀盐酸与氢氧化钠稀溶液发生了化学反应,并且
盐酸
盐酸
过量.(2)方案二:①向一小烧杯中加入约10mL稀氢氧化钠溶液,滴加2~3滴酚酞试液;②用胶头滴管吸取稀盐酸逐滴加入上述小烧杯中,边滴边用玻璃棒轻轻搅拌,当溶液刚好变成
无
无
色时,停止滴加稀盐酸.反应后溶液中的溶质可用蒸发结晶
蒸发结晶
的方法(填一操作名称)使其析出.(3)上述两个方案在设计思想上的共同点是
测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应
测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应
.除了上述两种方案外,还可用测温度变化检测中和反应是否发生,整个实验中,至少应测定溶液温度三
三
次.(4)在实施方案二时,为了检验稀盐酸是否恰好与氢氧化钠溶液完全反应,采用以下方法证明:取实验②反应后的溶液少许于试管中,再滴加1滴氢氧化钠稀溶液,溶液的颜色变为红色即可证明.该方法是否严密?
否
否
(选填“是”或“否”):同答“否”则需填写你认为更加合理的方案(不能增加新的药品和仪器)在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
.分析:(1)当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此根据氢氧化钠溶液的酸碱性进行分析判断.
根据题意,将一定量稀盐酸加入该氢氧化钠溶液中,混合均匀后测定混合溶液的pH小于7,则可判断出反应后酸过量;(2)根据碱溶液遇酚酞溶液变红,利用酸碱反发生中和反应使碱减少,据此判断颜色的变化;(3)中和反应为放热反应,根据测定反应前后、过程中溶液的温度变化来确定至少测定的次数.
根据题意,将一定量稀盐酸加入该氢氧化钠溶液中,混合均匀后测定混合溶液的pH小于7,则可判断出反应后酸过量;(2)根据碱溶液遇酚酞溶液变红,利用酸碱反发生中和反应使碱减少,据此判断颜色的变化;(3)中和反应为放热反应,根据测定反应前后、过程中溶液的温度变化来确定至少测定的次数.
解答:解:(1)氢氧化钠溶液显碱性,其pH大于7;将一定量稀盐酸加入该氢氧化钠溶液中,混合均匀后测定混合溶液的pH小于7,说明稀盐酸与氢氧化钠溶液发生了化学反应,且稀盐酸过量;
(2)酚酞溶液滴入到氢氧化钠溶液中显红色,当向氢氧化钠溶液中加入稀盐酸时,发生中和反应反应使碱减少至消失,则红色逐渐变浅直至消失刚好变成无色溶液呈中性,得到的溶液中溶质是氯化钠,通过蒸发溶剂可以得到氯化钠;.
(3)上述两个方案在设计思想上的共同点是测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应;中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测定起始温度,反应中测定温度是否升高,加入过量的盐酸再测定溶液的温度是否降低,故最少需要测定3次;
(4)取实验②反应后的溶液少许于试管中,如果其中含有少量过量的盐酸,加入1滴氢氧化钠后,溶液会变为显碱性,仍然能变红,所以应该在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
故答案为:(1)大于;盐酸;(2)无;蒸发结晶;(3)测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应;3;(4)否;在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
(2)酚酞溶液滴入到氢氧化钠溶液中显红色,当向氢氧化钠溶液中加入稀盐酸时,发生中和反应反应使碱减少至消失,则红色逐渐变浅直至消失刚好变成无色溶液呈中性,得到的溶液中溶质是氯化钠,通过蒸发溶剂可以得到氯化钠;.
(3)上述两个方案在设计思想上的共同点是测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应;中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测定起始温度,反应中测定温度是否升高,加入过量的盐酸再测定溶液的温度是否降低,故最少需要测定3次;
(4)取实验②反应后的溶液少许于试管中,如果其中含有少量过量的盐酸,加入1滴氢氧化钠后,溶液会变为显碱性,仍然能变红,所以应该在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
故答案为:(1)大于;盐酸;(2)无;蒸发结晶;(3)测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生化学反应;3;(4)否;在实验②反应后的溶液中直接滴加1滴氢氧化钠溶液,观察溶液颜色的变化.
点评:本题有一定难度,考查了中和反应及其应用,掌握中和反应、常见酸碱指示剂的性质、溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键.

练习册系列答案
相关题目
 20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: