题目内容
【题目】请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.18g/mL)配制200g10%稀盐酸。
①配制的主要步骤为:计算、 、溶解。
②设需浓盐酸的体积为V,请列出V的计算式 (不必算出结果)。
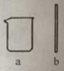
③现提供下图仪器,仪器a的名称为 ;配制过程中还需要的仪器有 。
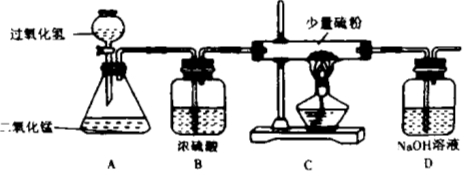
(2)现提供下列装置:
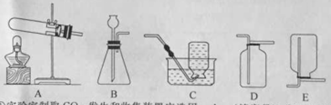
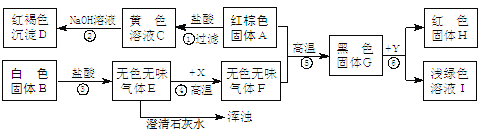
①实验室制取二氧化碳,发生和收集装置应选用 (填序号),发生反应的化学方程式为 。实验结束,从反应残留物中提取固体溶质时,按如下流程操作:
![]()
②如选用另一发生装置制取某种气体,发生反应的化学方程式为 。
【答案】(1)①称量②(200克×10%)/(1.18 g/mL×37%)③烧杯;量筒;滴管
(2)①B;D;CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O②2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】
试题分析:配制溶液的主要步骤为:计算、称量、溶解。设需浓盐酸的体积为V,根据溶液中溶质的质量在稀释的过程中不会改变的原则,列出V的计算式=(200克×10%)/(1.18 g/mL×37%);配制过程中还需要的仪器有滴管来滴加少量的液体,同时还需要量筒来量取液体,实验室制取二氧化碳不要需要加热,因此发生装置是B,二氧化碳能够和水反应所以收集装置应选用D,如选A作为发生装置制取某种气体,发生反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
【题目】除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 | 物质(括号内为杂质) | 选用试剂 | 操作方法 |
A | CO2(CO) | 过量O2 | 点燃 |
B | CaO(CaCO3) | 足量蒸馏水 | 过滤、蒸发 |
C | NaCl溶液(MgSO4溶液) | 适量BaCl2溶液 | 过滤 |
D | FeCl2溶液(CuCl2溶液) | 足量铁粉 | 过滤 |