题目内容
【题目】现有碳酸钠和氯化钠的固体混合样品。由下图实验过程和提供的数据可计算样品中碳酸钠的质量分数约为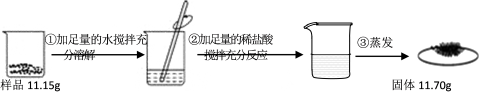 ( )
( )
A.47.5%
B.21.2%
C.70.7%
D.85.6%
【答案】A
【解析】向碳酸钠和氯化钠的固体混合物中,加入盐酸发生的反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑蒸发时,二氧化碳和水逸出,所以所得固体和原固体质量差为碳酸钠和生成氯化钠的质量差,设混合物中碳酸钠的质量为x,则
Na2CO3+2HCl= | 2NaCl+H2O+CO2↑ | 固体质量差 |
106 | 117 | 11 |
x | 0.55g |
106/x=11/0.55g x=5.3g
样品中碳酸钠的质量分数约为5.3g÷11.15g×100%≈47.5%
故答案为:A。
根据化学方程式及溶质质量分数的计算分析,注意溶液间发生反应时,参加反应的物质为溶液中的溶质。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目