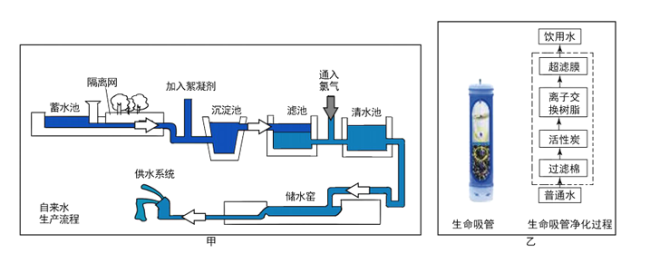
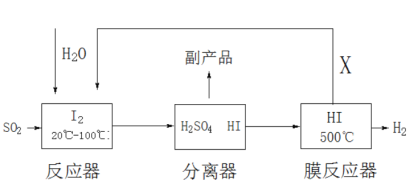
题目内容
【题目】为测定某碳酸钠样品中碳酸钠的含量(杂质不参加反应且部分不溶于水)。取样品20g,加入100g稀盐酸恰好完全反应,得固液混合物115.6g,过滤,滤渣1g,再向滤液中加入水185.4g,最终只得到氯化钠溶液请计算:
(1)样品中碳酸钠的质量为_____;
(2)最终得到的氯化钠溶液中溶质的质量分数为_____(计算结果精确到0.1%);
(3)若用36.5%的浓盐酸配制上述实验所用的稀盐酸,需要浓盐酸的质量为_____。
【答案】10.6g 6.7% 20g
【解析】
生成二氧化碳的质量:20g+100g-115.6g=4.4g
(1)设样品中碳酸钠的质量为x,消耗盐酸的质量为y,生成氯化钠的质量为z
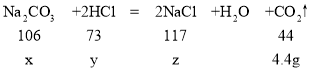
![]() x=10.6g
x=10.6g
![]() y=7.3g
y=7.3g
![]() z=11.7g
z=11.7g
(2)得到的氯化钠溶液中氯化制的质量为:11.7g+(20g-106g-1g)=20.1g
20.1g得到的氯化钠溶液中氯化钠质量分数:![]() ×100%=6.7%
×100%=6.7%
(3)设需要36.5%的浓盐酸的质量为a:36.59%a=7.3g,解得a=20g;
答:样品中碳酸钠的质量为10.6g,得到纯净的氯化钠溶液中溶质的质量分数6.7%,需浓盐酸的质量为20g。

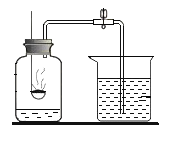
【题目】某化学兴趣小组想要探究一包食品脱氧剂的成分,剪开包装袋,发现脱氧剂大部分为黑色固体,其中混有少量白色粉末。
[提出问题]脱氧剂的成分是什么?
[猜想与假设]经过查阅资料,小组同学提出猜想:甲同学:可能有铁粉;乙同学:可能有炭粉。
[设计实验]小组同学根据两位同学的猜想设计了实验方案,请完成下表:
实验步骤 | 实验现象 | 实验结论 |
向脱氧剂中加入足量的稀盐酸 | 固体部分溶解,有气泡产生 | 甲、乙同学的猜想均成立 |
过滤,将滤渣与氧化铜混合加热 | _____ |
[反思与评价]
(1)有同学提出,可以用一种简单的物理方法验证甲同学的猜想,请写出使用此方法的实验操作及现象:_____。
(2)老师告诉同学们,脱氧剂的脱氧原理是利用铁与氧气、水反应生成氢氧化铁来吸收包装袋中氧气,从而延长食品的保质期。该反应的化学方程式是_____,所属的基本反应类型是_____
(3)小组同学又对脱氧剂中的白色粉末产生好奇,经查阅资料,白色粉末可能是硅藻土。硅藻土是一种填充剂,不溶于水,其作用在于吸附水分,为脱氧反应提供水分;并疏松配料,使氧气易于接触铁粉。如图是硅藻土用量与脱氧时间(h)的关系图,可知:
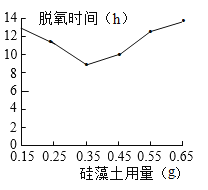
①硅藻土的最佳用量是0.35g.
②硅藻土高于或低于最佳量时,脱氧速度会减慢。请分别分析可能的原因:_____;
(4)脱氧剂的脱氧速度还有可能受哪些因素影响?请写出一条并说明理由,影响因素:_____理由:_____
【题目】分类、类比、模仿都是学习化学常用的方法。
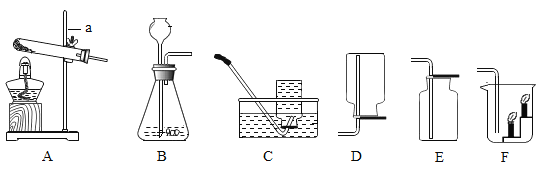
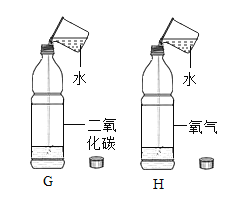
(1)不规范的实验操作会影响实验结果的准确性。下列是一些实验中常见的错误操作:
实验内容 |
|
|
|
|
A.测定空气中氧气的体积分数 | B.测NaOH溶液的pH | C.配制一定质量分数的氯化钠溶液 | D.蒸发食盐水 | |
错误操作 | 红磷的量不足 | 用蒸馏水润湿pH试纸 | 有一 部分溶剂酒到烧杯外 | 未等完全 蒸干就将产品转移到天平上 |
按照这些错误操作对“氧气的体积分数、溶液的pH、溶液的浓度、精盐的产率”四个实验结果的影响,可以将_____(填字母)归为一类,理由是这些操作都会使实验结果_____(选填“变大”、“变小”或“不变”)。
(2)在金属活动性顺序中,很活泼的金属投入CuSO4溶液中会发生如下反应:
以钠为例: ![]()
![]()
最后总反应的化学方程式可写为: ![]()
请你判断:总反应的化学方程式_____(填“是”或“不是" )置换反应。请你模仿金属钠与水的反应,写出金属钙与水反应的化学方程式_____。