题目内容
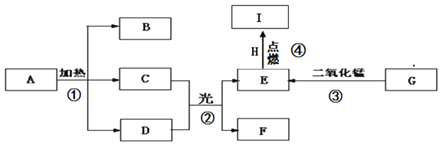
【题目】物质 X 在 4.8g 氧气中恰好完全燃烧,其化学方程式可表示为 4X+3O2=2R2+6H2O,测得 R2和 H2O 的质量分别为 2.8g 和 5.4g,下列判断中正确的是( )
A. X 的相对分子质量为 17
B. 该反应前后 R 元素的化合价降低了
C. 参加反应的 X 的质量为 4.4g
D. X 中一定含有 R、H 元素,可能含有氧元素
【答案】A
【解析】
根据质量守恒定律可得,参加反应的X的质量为2.8g+5.4g﹣4.8g=3.4g;
设:X的相对分子质量为a。
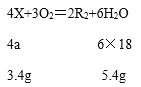
![]() a=17。
a=17。
A、X的相对分子质量为17,故A正确;
B、由于氧元素化合价降低,所以R的化合价应该是升高的,故B错误;
C、参加反应的X的质量为3.4g,而非4.4g,故C错误;
D、根据化学方程式4X+3O2=2R2+6H2O可知,反应前氧气中含有6个氧原子,反应后也有6个氧原子,所以X分子不含氧原子,即X不含氧元素,故D错误。故选A。

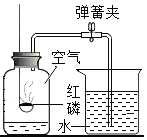
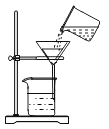
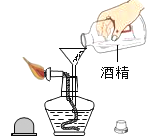
【题目】某课外小组的同学利用老师提供的下列仪器、药品进行实验探究
(1)甲同学设计了两种制取氧气的方案
A 把二氧化锰加入盛有过氧化氢溶液的试管中;
B 把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中。
能得到平稳氧气流的是_____,(填A或B)
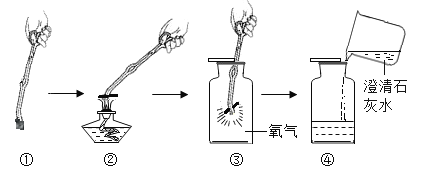
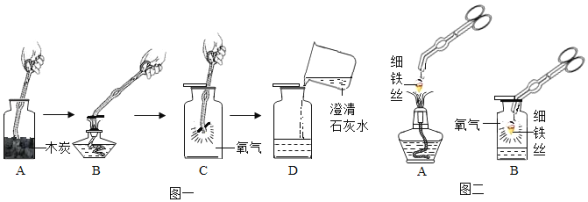
(2)老师提供的红砖粉末有什么作用?乙同学联想二氧化锰作过氧化氢的催化剂,于是想到红砖粉末是否也可以作过氧化氢的催化剂?请你一起参与探究,并回答有关问题
(猜想与假设)红砖粉末能作过氧化氢分解的催化剂。
(实验验证)乙同学设计了如下三个实验:
实验:取一定量过氧化氢溶液于试管中,观察到有极少量气泡产生,将带火星的木条伸入试管中,木条没有复燃。说明过氧化氢在常温下分解缓慢。
实验二:在实验一的试管中加入1克红砖粉末,有大量气泡产生,伸入带火星的木条,木条复燃。说明_____。
实验三:待反应结束后,将试管中的不溶物滤出,并洗涤、于燥、称量,固体的质量仍为1克,说明_____
(实验结论)乙同学认为红砖粉末可以作过氧化氢分解的催化剂。
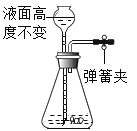
(反思评价)丙同学认为要证明乙同学的结论正确,还需要再补充一个探究实验这一探究实验的目的是_____。
(拓展)下表是丁同学探究影响过氧化氢分解速率的因素时所记录的数据,通过对数据的分析,你得到的结论是_____。
催化剂及其质量 反应结束所需要的时间/min 过氧化氢溶液的浓度 | 30% | 15% | 5% |
W克二氧化锰 | 0.3 | 0.9 | 2.1 |
W克红砖粉末 | 8.0 | 10.0 | 17.0 |