题目内容
(2013?槐荫区三模)(1)下表是KNO3在不同温度时的溶解度,请回答下列问题.
①分析表中数据,可知KNO3的溶解度随温度变化的规律是
②20℃时,在装有20gKNO3晶体的试管中,加入50g水并充分振荡,此时所得溶液质量为
③配制一定溶质质量分数的KNO3溶液时,溶解过程中所需要的玻璃仪器有烧杯和
(2)海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等,图2为综合利用海水制备金属镁的流程.在如图2所示的转化过程中,所发生的反应属于分解反应的是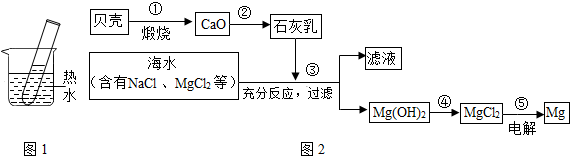
| 温度℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
随温度的升高而增大
随温度的升高而增大
.②20℃时,在装有20gKNO3晶体的试管中,加入50g水并充分振荡,此时所得溶液质量为
65.8
65.8
g.再将该试管放入盛有热水的烧杯中(图1),使试管内温度升至60℃,此时试管内的溶质与溶剂的质量比是2:5
2:5
.③配制一定溶质质量分数的KNO3溶液时,溶解过程中所需要的玻璃仪器有烧杯和
玻璃棒
玻璃棒
.(2)海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等,图2为综合利用海水制备金属镁的流程.在如图2所示的转化过程中,所发生的反应属于分解反应的是
①⑤
①⑤
(填反应顺序标号),写出过程②发生的化学反应方程式CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
.
分析:(1)①根据KNO3在不同温度时的溶解度,分析KNO3的溶解度随温度变化的规律;
②根据20℃时,KNO3的溶解度进行分析计算;
③根据配置溶液的过程分析用到的玻璃仪器;
(2)根据反应的过程分析发生的反应,判断反应的类型,写出符合反应的方程式.
②根据20℃时,KNO3的溶解度进行分析计算;
③根据配置溶液的过程分析用到的玻璃仪器;
(2)根据反应的过程分析发生的反应,判断反应的类型,写出符合反应的方程式.
解答:解:(1)①由KNO3在不同温度时的溶解度可知,KNO3的溶解度随温度变化的规律是随温度的升高而增大;
②在20℃时,KNO3的溶解度是31.6g,由溶解度的含义可知,在装有20gKNO3晶体的试管中,加入50g水并充分振荡,只能溶解15.8g,此时所得溶液质量为65.8g;由于在60℃时,KNO3的溶解度是110g,再将该试管放入盛有热水的烧杯中(图1),使试管内温度升至60℃,KNO3全部溶解,此时试管内的溶质与溶剂的质量比是2:5;
③配制一定溶质质量分数的KNO3溶液时,溶解过程中所需要的玻璃仪器有烧杯和玻璃棒;
(2)碳酸钙高温生成氧化钙和二氧化碳,属于分解反应;氧化钙与水结合生成氢氧化钙属于化合反应;氢氧化镁与盐酸反应生成氯化镁和水是复分解反应,氯化镁分解生成镁和氯气也属于分解反应;所以,属于分解反应的是①⑤,
②发生的化学反应方程式是:CaO+H2O=Ca(OH)2.
故答为:(1)①随温度的升高而增大;②65.8;③2:5;(2)①⑤,CaO+H2O=Ca(OH)2.
②在20℃时,KNO3的溶解度是31.6g,由溶解度的含义可知,在装有20gKNO3晶体的试管中,加入50g水并充分振荡,只能溶解15.8g,此时所得溶液质量为65.8g;由于在60℃时,KNO3的溶解度是110g,再将该试管放入盛有热水的烧杯中(图1),使试管内温度升至60℃,KNO3全部溶解,此时试管内的溶质与溶剂的质量比是2:5;
③配制一定溶质质量分数的KNO3溶液时,溶解过程中所需要的玻璃仪器有烧杯和玻璃棒;
(2)碳酸钙高温生成氧化钙和二氧化碳,属于分解反应;氧化钙与水结合生成氢氧化钙属于化合反应;氢氧化镁与盐酸反应生成氯化镁和水是复分解反应,氯化镁分解生成镁和氯气也属于分解反应;所以,属于分解反应的是①⑤,
②发生的化学反应方程式是:CaO+H2O=Ca(OH)2.
故答为:(1)①随温度的升高而增大;②65.8;③2:5;(2)①⑤,CaO+H2O=Ca(OH)2.
点评:本题考查了学生对溶解度的理解和应用,并考查了根据溶解度的数据分析就解决问题的能力,加深了对溶解度的意义的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?槐荫区三模)从如图所示的两种微粒结构示意图中,所获取信息不正确的是( )
(2013?槐荫区三模)从如图所示的两种微粒结构示意图中,所获取信息不正确的是( ) (2013?槐荫区三模)如图所示是某个化学反应的微观模拟示意图,下列说法正确的是( )
(2013?槐荫区三模)如图所示是某个化学反应的微观模拟示意图,下列说法正确的是( )