题目内容
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制200g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,然后 (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
该步骤中用烧杯而不用纸称量氢氧化钠的原因是 .
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)如图表示用上述配制的氢氧化钠溶液与20 g某稀盐酸发生反应后溶液温度的变化情况。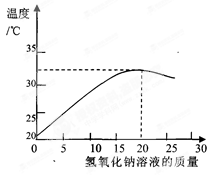
①根据曲线判断,当加入氢氧化钠溶液的质量为 时,反应恰好完全进行。
②当加入15 g氢氧化钠溶液时,所得溶液中的溶质为 (写化学式)。
③试计算上述完全反应后所得溶液的溶质质量分数(请写出计算过程) 。
(1)①16 184 ② B A 氢氧化钠易潮解(或氢氧化钠具有腐蚀性)
(2)①20g ② NaCl、HCl ③ 5.85%
解析试题分析:(1)①根据溶质质量分数计算的表达式可以得出,溶质的质量=溶液的质量×溶质质量分数,需要氢氧化钠固体的质量=200g×8%=16g,水的质量=200g-16g=184g,在根据水的密度1g/cm3,所以水的体积为=184mL;②称量固定物质质量,应先固定砝码和游码,然后再增减药品,所以操作的先后顺序是:B A,由于氢氧化钠易潮解(或氢氧化钠具有腐蚀性),所以称量氢氧化钠固体的时候不能用纸称量,而应该放在玻璃器皿中(烧杯、表面皿)
(2)酸碱中和反应会放出热量,所以随着反应的进行,热量不断放出,当反应停止时,放出的热量最大,图象显示:当加入氢氧化钠溶液的质量为20g,温度最高,表示反应恰好完全进行
(3)因为上题告诉我们:当加入氢氧化钠溶液的质量为20g,表示反应恰好完全进行,所以当加入15 g氢氧化钠溶液时,表示稀盐酸过量,故所得溶液中的溶质除了生成的NaCl,还有过量的HCl
(4)当加入氢氧化钠溶液的质量为20g,质量分数为8%,表示反应恰好完全进行,即消耗的氢氧化钠质量=20g×8%=1.6g,再根据化学方程式:NaOH+HCl=NaCl+H2O,算出生成溶质NaCl的质量
解:设生成溶质NaCl的质量为x
NaOH+HCl=NaCl+H2O
40 58.5
1.6g x
40:58.5 = 1.6g:x
x = 2.34g
∴ 所得溶液的溶质质量分数=2.34g/20g+20g×100%=5.85%[
考点:溶液的配制,中和反应,根据化学方程式进行计算

 名校通行证有效作业系列答案
名校通行证有效作业系列答案