题目内容
【题目】日常生活中接触的金属材料,大多属于合金。其中黄铜是以锌作主要添加元素的铜合金。已知组成某弹壳的黄铜中只含有锌和铜,现将22 g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测得反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示。试计算:
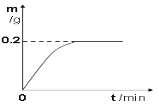
(1)由题意可知,反应生成氢气的质量共_____g;
(2)弹壳中铜的质量(精确至0.1)
(3)若欲计算反应后所得溶液的质量,你认为至少还应该补充的一个条件是_________________。
【答案】0.2g ; 15.5g; 反应前稀硫酸的质量
【解析】
试题分析:(1)根据图示可知,反应产生氢气质量为0.2g;
(2)根据氢气的质量利用化学方程式进行计算得出锌的质量即可。具体步骤如下:
解:(2)设黄铜中锌的质量为x
Zn+H2SO4==ZnSO4+H2↑
65 2
x 0.2g
65:2=x:0.2g
x=6.5g
则弹壳中铜的质量为:22g—6.5g=15.5g
(3)要想计算反应后所得硫酸锌溶液质量,应该补充的一个条件是反应前稀硫酸的质量

练习册系列答案
相关题目