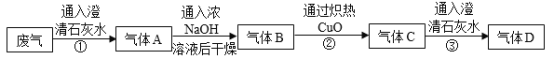
题目内容
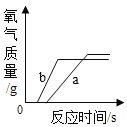
【题目】等质量的Zn、A1粉末分别与足量稀盐酸进行反应,生成H2的质量与反应时间的关系如图所示,下列说法中正确的是( )
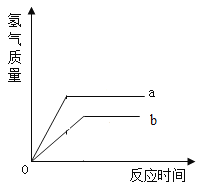
A.曲线a表示的是Al
B.放出H2质量:Zn>Al
C.产生H2速率:Zn>Al
D.产物中金属离子的化合价都是+2
【答案】A
【解析】
锌和稀盐酸反应的方程式为:Zn+2HCl=ZnCl2+H2↑,铝和稀盐酸反应的方程式为:2Al+6HCl=2AlCl3+3H2↑。通过方程式可知,65份质量的锌产生2份质量的氢气,54份质量的铝产生6份质量的氢气。
锌、铝的质量相同,稀盐酸足量,则铝反应产生氢气的质量大于锌反应产生氢气的质量。
A、通过分析可知,a曲线描述的是铝,b曲线描述的是锌。故A正确;
B、通过分析图像可知,铝反应产生氢气的质量大于锌反应产生氢气的质量。故B错误;
C、产生氢气的速率指的是单位时间内产生氢气的质量。单位时间内,产生的氢气越多,则反应速率越快。通过图像可知,a>b,则产生氢气的速率是Al>Zn。故C错误;
D、通过分析可知,反应后的金属阳离子是Al3+、Zn2+。铝离子的化合价是+3价,锌离子的化合价为+2价。故D错误。
故选A。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
【题目】下列图像能正确反映对应的变化关系的是
|
|
|
|
A向a.b两支试管中分别加入等质量的样品,a中是氯酸钾,b中是氯酸钾和少量二氧化锰 | B利用红磷燃烧测定空气中氧气的含量(打开止水夹前) | C向一定质量AgNO3和Cu(NO3)2的混和溶液中逐渐加入足量的锌粒 | DCO和过量的氧气在密闭容器中完全反应 |
A.AB.BC.CD.D