题目内容
【题目】Ⅰ.质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是_____(填标号)。
A.蔗糖和水 B.氯化钠溶液和硝酸钾溶液
C.铁和氯化铜溶液
(2)在氧气中点燃红磷的实验过程,固体变化如图所示。
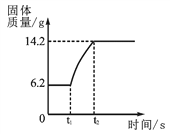
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是__________________。
②该反应的化学方程式为____________________________。
③参加反应的氧气质量为______________g。
(3)下图是某反应的微观示意图。
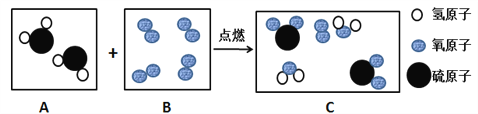
请回答:
①B框中的物质属于________(填序号:a、化合物 b、单质 c、纯净物 d、混合物)。
②此反应的化学方程式为________________________________。
Ⅱ.甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如下图所示。
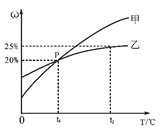
(1)甲和乙两种物质的溶解度随温度的升高而________(填“增大”或“减小”)。
(2)下列对P点的含义叙述正确的是______(填标号)。
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(3)25g乙物质完全溶于100g水中所需的最低温度是______℃。
(4)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是________(填“甲”或“乙”)物质饱和溶液。
【答案】 C 温度未达到红磷的着火点 4P + 5O2 点燃 2P2O5 8.0 b、c 2H2S+3O2![]() 2SO2+2H2O 增大 A t1 乙
2SO2+2H2O 增大 A t1 乙
【解析】Ⅰ.(1)验证质量守恒定律的必须是化学变化,故选C。(2)①可燃物与空气接触,温度达到着火点才能燃烧。②该反应的化学方程式为4P+5O2点燃2P2O5 ③根据质量守恒定律,参加反应的氧气质量为14.2g-6.2g=8g (3)①B框中含有同种分子,属于纯净物,是同种原子构成的分子,属于单质,故选bc。②A中是硫化氢分子,B中是氧分子,C中是二氧化硫分子和水分子,故此反应的化学方程式为2H2S+3O2 点燃 2SO2+2H2O Ⅱ.(1)甲和乙两种固态物质的饱和溶液中溶质质量分数随温度升高而增大,故甲和乙两种物质的溶解度随温度的升高而增大。(2)此图表示甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系,P点表示t1℃时,甲和乙两种物质的饱和溶液中溶质的质量分数相等,即t1℃时,甲和乙两种物质的溶解度相等,故选A。(3)25g乙物质完全溶于100g水中所形成溶液的溶质质量分数为![]() ×100%=20%,故填 t1。(4)t2℃时,甲饱和溶液中溶质质量分数大于乙饱和溶液中溶质质量分数,即t2℃时,甲的溶解度大于乙的溶解度,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙。
×100%=20%,故填 t1。(4)t2℃时,甲饱和溶液中溶质质量分数大于乙饱和溶液中溶质质量分数,即t2℃时,甲的溶解度大于乙的溶解度,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是乙。