题目内容
【题目】医用消毒酒精为75%的乙醇溶液,化工生产中可用A(主要成分的化学式为C8H18)作原料,经以下流程制取乙醇:
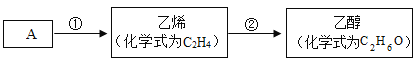
(1)步骤①的转化属于_____(选填“化学”或“物理”)变化。
(2)步骤②是乙烯和含两种元素的化合物B发生化合反应,则B中所含元素是_____。
【答案】化学 氢元素、氧元素
【解析】
生成新物质的变化是化学变化;
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
(1)步骤①的C8H18转化成乙烯,生成了新物质,是化学变化。
故填:化学。
(2)步骤②是乙烯(C2H4)和含两种元素的化合物B发生化合反应生成乙醇(C2H6O),根据质量守恒定律,化学反应前后,原子的种类和数目不变,乙烯含2个碳原子、4个氢原子,乙醇含2个碳原子、6个氢原子,1个氧原子,故B中含2个氢原子,1个氧原子,所含元素是氢元素、氧元素。
故填:氢元素、氧元素。

 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
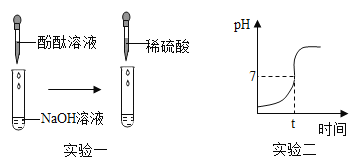
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
【题目】根据所学的酸、碱、盐知识回答问题:(可参考提供的溶解性表)
部分碱、酸、盐的溶解性表(20℃)
阴离子 阳离子 | OH- | NO3- | C1- | SO42- | CO32- |
H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
K+ | 溶 | 溶 | 溶 | 溶 | 溶 |
Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
Cu2+ | 不 | 溶 | 溶 | 溶 | 一 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示那种物质不存在或遇到水就分解了。
(1)已知溶液中氢离子浓度越大,溶液的酸性越强,溶液的pH越小。有一同学在实验室中是这样测某溶液pH的:他先用蒸馏水润湿pH试纸,然后用____________(填仪器名称)蘸取试样进行检测,该同学测得的pH是否一定会有误差?__________________
(2)盐中含有金属离子(或NH4+)和酸根离子,组成相似的盐具有一些相似的化学性质。
①硫酸铜、硝酸铜两种物质的溶液均显_____________色,因为它们都具有相同的阳离子;向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式______________。
② 向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是____________(填化学式),另外一种物质不反应。
③向硫酸铜溶液中,加入某纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学为______________。
(3)某实验小组将制作皮蛋的原料生石灰、纯碱和食盐放入水中,充分反应后过滤,得到澄清溶液。对该溶液的组成,甲、乙同学分别做出以下推测:

①我认为上述两位同学的推测都有不足,理由是甲:_____;乙:____。
②我的推测是:该溶液中一定存在的溶质是________________。为进一步确定该溶液可能的组成,还需设计实验并填写下表:(将答案按a-f的顺序填在答题卡上)
实验操作 (填所加试剂的化学式) | 实验现象 | 结论 |
| b__________ | 除了②推测的一定存在的溶质 外,该溶液中还含有: _____________________ |
| e__________ | 除了②推测的一定存在的溶质 外,该溶液中还含有: ____________________ |
上述两实验均无明显现象 | 只含有②推测的一定存在的溶质 |
【题目】溶液普遍存在于生活中。通过科学探究中的控制变量法可以测得物质的溶解度。
(1)在探究固体物质溶解度时,需考虑的因素有a.溶质的种类;b.______________________;c.溶剂的温度;d.溶剂的质量;e.溶质被溶剂溶解的最大值。若要测定“某种固体物质在不同温度时的溶解度”,其研究所指的是_________________________受温度变化的影响,实验必须严格控制其它因素保持不变。
(2)下表格是根据控制变量法测得:在不同温度时,两种固体物质在水中的溶解度。
温度°C | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①从上表可知,两种物质溶解度受温度变化影响较小的是__________________。
②据上表推测,氯化钠和硝酸钾溶解度相等时温度范围在_________________。
A 10℃-20℃
B 20℃~30℃
C 30℃~40℃
③若在氯化钠中混有少量的硝酸钾,提纯氯化钠的方法是_________________。
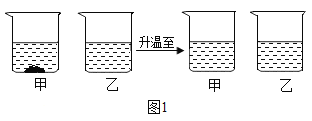
(3)20℃时,将等质量的氯化钠、硝酸钾分别放入盛有100g水的甲、乙烧杯中,充分溶解后再升温到40℃。其实验过程如图所示:40℃时甲烧杯中的溶液状态为________________(填“饱和溶液”“不饱和溶液”或“不能确定”)。
(4)乐乐同学取氯化钠、硝酸钾中的一种物质,按照下图所示进行一系列实验操作。
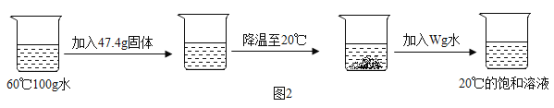
该同学所取的物质是______________________,W的数值为___________________。
(5)小明同学帮助实验员老师配制5%的氯化钠溶液80g(水的密度为1g.mL-1),正确的实验操作顺序标号为___________________。
A 用托盘天平称量4.0g的氯化钠固体
B 用托盘天平称量5.0g的氯化钠固体
C 将固体氯化钠和水在小烧杯中混合
D 将配制好的溶液装瓶,贴上标签
E 用100mL量筒量取76.0mL水
F 用200mL量筒量取75.0mL水