题目内容
(3分)为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
请你计算:
(1)所用稀盐酸中溶质的质量分数。
(2)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量。
(3)黄铜样品中铜的质量分数。
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀盐酸质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 9.10 | 8.45 | 7.80 | 7.80 |
(1)所用稀盐酸中溶质的质量分数。
(2)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量。
(3)黄铜样品中铜的质量分数。
【解】设参加反应的HCl 的质量为x
Zn的质量=" 0.65g" × 3 = 1.95g
Zn + 2HCl ZnCl2+H2↑
65 73
1.95g x
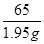 =
=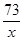 或
或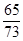 =
=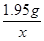
x = 73×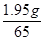 = 2.19g
= 2.19g
稀盐酸中溶质HCl的质量分数=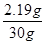 × 100% = 7.3%……………………1分
× 100% = 7.3%……………………1分
需要浓盐酸的质量=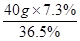 = 8g………………………………………1分
= 8g………………………………………1分
黄铜中铜的质量分数=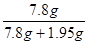 × 100% = 80%………………………1分
× 100% = 80%………………………1分
答:稀盐酸中溶质HCl的质量分数为7.3%,需要浓盐酸的质量为8g,黄铜中铜的质量分数为80%。(其他方法合理给分)
Zn的质量=" 0.65g" × 3 = 1.95g
Zn + 2HCl ZnCl2+H2↑
65 73
1.95g x
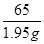 =
=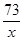 或
或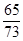 =
=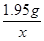
x = 73×
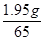 = 2.19g
= 2.19g 稀盐酸中溶质HCl的质量分数=
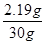 × 100% = 7.3%……………………1分
× 100% = 7.3%……………………1分需要浓盐酸的质量=
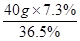 = 8g………………………………………1分
= 8g………………………………………1分黄铜中铜的质量分数=
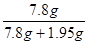 × 100% = 80%………………………1分
× 100% = 80%………………………1分答:稀盐酸中溶质HCl的质量分数为7.3%,需要浓盐酸的质量为8g,黄铜中铜的质量分数为80%。(其他方法合理给分)
试题分析:根据题中数据可知,第一次加盐酸反应掉的锌的质量与第二次、第三次反应的锌的质量相等,都是0.65克。故样品中锌的质量为:0.65g × 3 = 1.95g;
设:反应中共用去HCl的质量为x。
Zn + 2HCl ZnCl2+H2↑
65 73
1.95g x
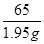 =
=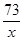 或
或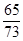 =
=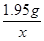
x = 73×
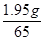 = 2.19g
= 2.19g 稀盐酸中溶质HCl的质量分数=
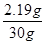 × 100% =" 7.3%"
× 100% =" 7.3%" (2)浓盐酸稀释成稀盐酸后,HCl的质量不变。
需要浓盐酸的质量=
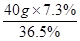 = 8g
= 8g(3)黄铜样品中铜的质量分数=
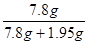 × 100% = 80%
× 100% = 80%点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
浓溶液稀释成稀溶液后,溶质的质量不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目