题目内容
【题目】小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫酸(H2SO4)在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
(1)提出假设:物质发生化学变化后,总质量______(填“变”或“不变)
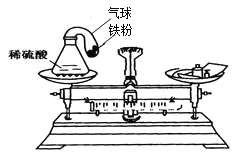
(2)设计实验方案:按你的假设小明设计了如图装置的实验,实验进行时把气球中的铁粉倒入稀硫酸中, 此反应的化学方程式为__________.反应后, 你认为天平最终能平衡吗?说出你的理由.__________________.
【答案】 不变 Fe+H2SO4 =FeSO4+H2 不平衡,反应产生了气体,使气球胀大,而胀大的气球会产生浮力,所以终天平不平衡
【解析】(1)物质发生化学变化后,总质量不变;(2)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑;天平最终不能平衡,这是因为生成的氢气由气球收集起来,气球膨胀后受到向上的浮力,导致托盘天平失去平衡。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】用燃烧红磷的方法测定空气中氧气的含量:
实验步骤:在集气瓶中加入少量水,并将水面上方空间分成5等份,如图装置所示.用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.

(1)写出红磷在空气中燃烧的化学方程式___________________________.
(2)反应结束后集气瓶中剩余的气体主要是__________,由此可以推测它具有的性质是__________(至少写一点).
(3)查阅资料得知“铜+氧气![]() 氧化铜”.乙同学又设计了如图2两种装置测定空气中氧气含量,请结合图示回答有关问题.
氧化铜”.乙同学又设计了如图2两种装置测定空气中氧气含量,请结合图示回答有关问题.
①装置一和装置二中气球的位置不同,你认为__________________(填“装置一”或“装置二”)更合理.理由___________________________.
②用合适的装置进行实验,并记录了如下实验数据
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 充分反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL | ? |
根据实验数据测得空气中氧气的体积分数为________________.
(4)以下是乙同学对自己实验结果的分析,其中解释不合理的是__________(填序号).
A.可能是使用的铜粉量过量
B.可能是没有反复推、拉注射器的活塞,装置内氧气没有充分反应
C.可能是没有冷却至室温就读数
D.可能是装置气密性不好,冷却时外界空气进入.