题目内容
【题目】实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图所示.请回答下列问题: 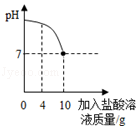
(1)当pH为4时溶液中的溶质是;
(2)计算当pH刚好为7时所得溶液的溶质质量分数.(写出计算过程)
【答案】
(1)HCl和NaCl
(2)解:通过图象可以看出,恰好完全反应,消耗的盐酸是10g,
设生成氯化钠为x,
NaOH+HCl═ | NaCl+H2O |
40 | 58.5 |
10%×8g | x |
![]()
x=1.17g
所以溶液的溶质质量分数为: ![]() ×100%=6.5%.
×100%=6.5%.
【解析】解:(1)当pH为4时,溶液显酸性,所以盐酸过量,盐酸和氢氧化钠反应生成氯化钠和水,所以溶液中的溶质是HCl和NaCl;
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
相关题目
【题目】小海看到妈妈炒的紫色卷心菜,紫色菜汁因为加醋而变成红色,洗盘子时遇到碱性洗涤剂又变成黄绿色。下列也能使紫色菜汁呈黄绿色的物质是 ( )
物质 | 柠檬汁 | 肥皂水 | 食盐水 | 雪碧 |
pH | 1.5 | 8.8 | 7.0 | 4.5 |
A.柠檬汁 B.肥皂水 C.食盐水 D.雪碧