题目内容
 (1)等质量的Mg、Al、Fe分别与过量的酸反应产生的氢气的质量由大到小的顺序是
(1)等质量的Mg、Al、Fe分别与过量的酸反应产生的氢气的质量由大到小的顺序是| 金属的质量×化合价 |
| 金属的相对原子质量 |
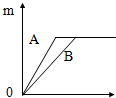
(2)如图表示相同质量的锌和铁分别与等质量同种稀硫酸反应的情况.t表示反应时间,m表示生成H2的质量.由图可知:A是金属
考点:金属的化学性质
专题:金属与金属材料
分析:(1)由金属活动性顺序可知反应速率快慢与金属活动性顺序有关,根据产生氢气的质量为:m(H2)=
计算得出结论或产生氢气的多少根据化学方程式进行计算;
(2)从图象的横坐标上得知A物质要比B物质反应用的时间短,即A的活泼性要比B强;从图象纵坐标得知:锌和铁与稀硫酸反应产生的氢气相同,说明锌和铁已经将等质量的稀硫酸反应掉.
| 金属的质量×化合价 |
| 金属的相对原子质量 |
(2)从图象的横坐标上得知A物质要比B物质反应用的时间短,即A的活泼性要比B强;从图象纵坐标得知:锌和铁与稀硫酸反应产生的氢气相同,说明锌和铁已经将等质量的稀硫酸反应掉.
解答:解:(1)根据“相同质量的Mg、Al、Fe三种金属,分别跟过量的酸反应”,则设金属质量都为1g,则产生氢气的质量由大到小的排列顺序为:
>
>
,
或由镁、铝、铁与酸,如盐酸反应的化学方程式可知,要生成2份质量的氢气,需要镁24份,铝18份,铁56份,所以等质量的Mg、Al、Fe分别与足量盐酸反应,产生氢气最多的是Al,其次是Mg,最少的是Fe.
故答案为:Al、Mg、Fe;
(2)金属越活泼反应就越剧烈,所用的时间就少,所以A是锌,B是铁;两种金属与酸反应产生的氢气相同说明金属有剩余,酸全反应掉.
故答案为:锌,铁;锌和铁已经将等质量的稀硫酸耗尽,最终产生的氢气质量相等.
| 1×3 |
| 27 |
| 1×2 |
| 24 |
| 1×2 |
| 56 |
或由镁、铝、铁与酸,如盐酸反应的化学方程式可知,要生成2份质量的氢气,需要镁24份,铝18份,铁56份,所以等质量的Mg、Al、Fe分别与足量盐酸反应,产生氢气最多的是Al,其次是Mg,最少的是Fe.
故答案为:Al、Mg、Fe;
(2)金属越活泼反应就越剧烈,所用的时间就少,所以A是锌,B是铁;两种金属与酸反应产生的氢气相同说明金属有剩余,酸全反应掉.
故答案为:锌,铁;锌和铁已经将等质量的稀硫酸耗尽,最终产生的氢气质量相等.
点评:本题考查了金属与酸反应产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.易错点是金属铝与盐酸反应中的质量关系计算.

练习册系列答案
相关题目
勾兑的酱油中常含有一种叫氯丙醇的致癌物质,其化学式为C3H7OCl,则关于氯丙醇的说法中正确的是( )
| A、氯丙醇中氢元素的质量分数为7% |
| B、氯丙醇的相对分子质量为94.5 |
| C、氯丙醇由3个碳原子、7个氯原子、1个氧原子、1个氯原子组成 |
| D、氯丙醇中碳、氢、氧、氯四种元素的质量比为3:7:1:1 |
 人类的生产生活离不开金属,铁是目前使用最广泛的金属.
人类的生产生活离不开金属,铁是目前使用最广泛的金属.
