题目内容
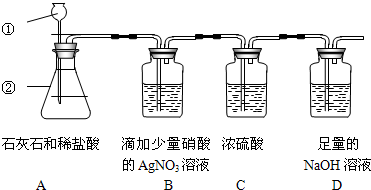
为了测定石灰石的纯度,有下列实验装置可供选择,已知石灰石中所含杂质不与盐酸反应,从装置A中导出的气体混有少量的氯化氢气体和水蒸气,试回答下列有关问题:
(1)写出装置A中有下列标号的仪器名称:①
(2)写出装置A中反应的化学方程式
(3)实验时有关装置导管口的连接顺序为:a接
(4)要计算出石灰石中碳酸钙的质量分数,在实验过程中最少需要进行

(1)写出装置A中有下列标号的仪器名称:①
长颈漏斗
长颈漏斗
,②锥形瓶
锥形瓶
;(2)写出装置A中反应的化学方程式
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
;(3)实验时有关装置导管口的连接顺序为:a接
g
g
、f
f
接e
e
、d
d
h;(4)要计算出石灰石中碳酸钙的质量分数,在实验过程中最少需要进行
3
3
次称量.分析:(1)根据实验室常用的仪器写出名称;
(2)根据反应事实写出方程式;
(3)根据除杂的顺序一般是先除杂再干燥,并且导气管是“长进短出”使反应彻底来分析;
(4)根据碳酸钙的质量分数的公式推算.
(2)根据反应事实写出方程式;
(3)根据除杂的顺序一般是先除杂再干燥,并且导气管是“长进短出”使反应彻底来分析;
(4)根据碳酸钙的质量分数的公式推算.
解答:解:(1)①是长颈漏斗;②是锥形瓶;
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,故方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)二氧化碳中混有氯化氢和水蒸气,要得到纯净干燥的二氧化碳,需要先除杂再干燥,即:先通过硝酸银溶液除去氯化氢,再通过浓硫酸除去水蒸气;然后纯净干燥的二氧化碳在通过氢氧化钠溶液,通过称量反应前后氢氧化钠溶液增重的量变可知反应产生的二氧化碳的质量;为了除杂吸收彻底,导气管是“长进短出”的连接顺序.
故答案为:a接g f接e d接h;
(4)碳酸钙的质量分数取决于碳酸钙的质量与石灰石质量的比值,故需称量石灰石的质量;而碳酸钙的质量根据反应产生的二氧化碳的质量计算,二氧化碳的质量有通过氢氧化钠溶液吸收,故需要称量吸收前后氢氧化钠溶液的质量,需要称量2次,所以共需要称量3次.
故答案为:(1)长颈漏斗 锥形瓶(2)CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)a接g f接e d接h (4)3次
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,故方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)二氧化碳中混有氯化氢和水蒸气,要得到纯净干燥的二氧化碳,需要先除杂再干燥,即:先通过硝酸银溶液除去氯化氢,再通过浓硫酸除去水蒸气;然后纯净干燥的二氧化碳在通过氢氧化钠溶液,通过称量反应前后氢氧化钠溶液增重的量变可知反应产生的二氧化碳的质量;为了除杂吸收彻底,导气管是“长进短出”的连接顺序.
故答案为:a接g f接e d接h;
(4)碳酸钙的质量分数取决于碳酸钙的质量与石灰石质量的比值,故需称量石灰石的质量;而碳酸钙的质量根据反应产生的二氧化碳的质量计算,二氧化碳的质量有通过氢氧化钠溶液吸收,故需要称量吸收前后氢氧化钠溶液的质量,需要称量2次,所以共需要称量3次.
故答案为:(1)长颈漏斗 锥形瓶(2)CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)a接g f接e d接h (4)3次
点评:在除杂时,除杂的顺序一般是先除杂再干燥,并且导气管是“长进短出”使反应彻底;在计算时,可以采用“逆推法”,即从问题出发,一步步寻找出要求的量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目