题目内容
 周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.I.定性探究:
【提出问题】该红色粉末是由哪些物质组成的?
【猜 想】红色粉末可能是:①Cu ②Fe2O3 ③
Cu和Fe2O3
Cu和Fe2O3
【查阅资料】Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【设计实验】(1)小玲取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想
①
①
一定不成立,其中一定发生反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
.(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到
铁丝表面有一层红色物质析出
铁丝表面有一层红色物质析出
现象,得出猜想③成立.Ⅱ.定量探究:
【提出问题】该红色粉末中氧化铁的质量分数是多少呢?
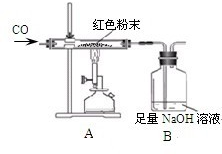
【设计实验】小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验.开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 |
洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
(1)A装置中发生反应的化学方程式为
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为
80%
80%
.(3)从环保角度看上述装置有严重不足之处.你认为应该如何改进?
在B导管口处放一盏燃着的酒精灯
在B导管口处放一盏燃着的酒精灯
.Ⅲ.拓展延伸
【提出问题】实验后B装置洗气瓶内溶液中的溶质是什么呢?
【设计实验】小华同学取该洗气瓶内溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,共用去稀盐酸60克,所得溶液质量为107.8克.通过计算回答:
(1)生成二氧化碳
2.2
2.2
克.(2)从洗气瓶内取出的50克溶液中碳酸钠的质量是多少?(请写出计算过程)
(3)Ⅱ中定量实验结束后洗气瓶内溶液中的溶质是
NaCl
NaCl
.分析:【猜想】根据红色固体是一种或两种组成猜想;
(1)根据铜不与盐酸反应及氧化铁与盐酸反应得有色溶液分析
(2)根据信息铜能与氯化铁反应生成氯化铜,铁与氯化铜反应生成铜分析
【交流讨论】
(1)根据书写化学方程式的原则书写方程式
(2)根据元素质量守恒及质量分数的计算公式分析
(3)根据一氧化碳的毒性分析
(4)根据质量守恒定律计算二氧化碳的质量,根据化学方程式中二氧化碳的质量求出碳酸钠的质量.
(1)根据铜不与盐酸反应及氧化铁与盐酸反应得有色溶液分析
(2)根据信息铜能与氯化铁反应生成氯化铜,铁与氯化铜反应生成铜分析
【交流讨论】
(1)根据书写化学方程式的原则书写方程式
(2)根据元素质量守恒及质量分数的计算公式分析
(3)根据一氧化碳的毒性分析
(4)根据质量守恒定律计算二氧化碳的质量,根据化学方程式中二氧化碳的质量求出碳酸钠的质量.
解答:解:【猜想】根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成,因此猜想 ③为 Cu和Fe2O3
【设计实验】(1)因为铜与稀盐酸不反应,因此取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后固体全部溶解,得有色溶液,说明猜想 ①一定不成立,一定含有氧化铁,一定发生反应的化学方程式为 Fe2O3+6HCl═2FeCl3+3H2O,可能含有铜
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,若猜想③成立.铜与氯化铁反应生成氯化铜,铁与氯化铜反应生成红色的铜,因此可观察到 铁丝表面有一层红色物质析出
【交流讨论】
(1)A装置中一氧化碳还原氧化铁生成铁和二氧化碳,发生反应的化学方程式为 3CO+Fe2O3
2Fe+3CO2.
(2)玻璃管中反应前后固体质量的变化量就是氧化铁中氧元素的质量,根据上述表格中的实验数据可知氧元素质量为48.3g-47.1g=1.2g,则氧化铁的质量为
=4g,则氧化铁的质量分数为
×100%=80%.
(3)一氧化碳有毒,排放到空气中会污染空气,因此应在B导管口处放一盏燃着的酒精灯将一氧化碳通过燃烧转化为二氧化碳除去.
Ⅲ.拓展延伸
解:(1)生成二氧化碳的质量为50g+60g-107.8g=2.2g
(2)设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g
(3)盐酸与碳酸钠反应生成氯化钠,因此定量实验结束后洗气瓶内溶液中的溶质是NaCl
故答案为:
【猜想】③Cu和Fe2O3
【设计实验】(1)①Fe2O3+6HCl═2FeCl3+3H2O.
(2)铁丝表面有一层红色物质析出
【交流讨论】
(1)3CO+Fe2O3
2Fe+3CO2.
(2)80%.
(3)在B导管口处放一盏燃着的酒精灯
【设计实验】(1)2.2g(2)5.3g(3)NaCl
【设计实验】(1)因为铜与稀盐酸不反应,因此取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后固体全部溶解,得有色溶液,说明猜想 ①一定不成立,一定含有氧化铁,一定发生反应的化学方程式为 Fe2O3+6HCl═2FeCl3+3H2O,可能含有铜
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,若猜想③成立.铜与氯化铁反应生成氯化铜,铁与氯化铜反应生成红色的铜,因此可观察到 铁丝表面有一层红色物质析出
【交流讨论】
(1)A装置中一氧化碳还原氧化铁生成铁和二氧化碳,发生反应的化学方程式为 3CO+Fe2O3
| ||
(2)玻璃管中反应前后固体质量的变化量就是氧化铁中氧元素的质量,根据上述表格中的实验数据可知氧元素质量为48.3g-47.1g=1.2g,则氧化铁的质量为
| 1.2g×160 |
| 48 |
| 4g |
| 5g |
(3)一氧化碳有毒,排放到空气中会污染空气,因此应在B导管口处放一盏燃着的酒精灯将一氧化碳通过燃烧转化为二氧化碳除去.
Ⅲ.拓展延伸
解:(1)生成二氧化碳的质量为50g+60g-107.8g=2.2g
(2)设碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
x=5.3g
(3)盐酸与碳酸钠反应生成氯化钠,因此定量实验结束后洗气瓶内溶液中的溶质是NaCl
故答案为:
【猜想】③Cu和Fe2O3
【设计实验】(1)①Fe2O3+6HCl═2FeCl3+3H2O.
(2)铁丝表面有一层红色物质析出
【交流讨论】
(1)3CO+Fe2O3
| ||
(2)80%.
(3)在B导管口处放一盏燃着的酒精灯
【设计实验】(1)2.2g(2)5.3g(3)NaCl
点评:本题综合考查了金属的化学性质以及根据化学方程式的计算,综合性较强

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
I.定性探究:
【提出问题】该红色粉末是由哪些物质组成的?
【猜 想】红色粉末可能是:①Cu ②Fe2O3 ③
【查阅资料】Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【设计实验】(1)小玲取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想 一定不成立,其中一定发生反应的化学方程式为 .
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到 现象,得出猜想③成立.
Ⅱ.定量探究:
【提出问题】该红色粉末中氧化铁的质量分数是多少呢?
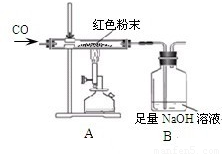
【设计实验】小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验.开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
【交流讨论】
(1)A装置中发生反应的化学方程式为 .
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为 .
(3)从环保角度看上述装置有严重不足之处.你认为应该如何改进? .
Ⅲ.拓展延伸
【提出问题】实验后B装置洗气瓶内溶液中的溶质是什么呢?
【设计实验】小华同学取该洗气瓶内溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,共用去稀盐酸60克,所得溶液质量为107.8克.通过计算回答:
(1)生成二氧化碳 克.
(2)从洗气瓶内取出的50克溶液中碳酸钠的质量是多少?(请写出计算过程)
(3)Ⅱ中定量实验结束后洗气瓶内溶液中的溶质是 .
I.定性探究:
【提出问题】该红色粉末是由哪些物质组成的?
【猜 想】红色粉末可能是:①Cu ②Fe2O3 ③
【查阅资料】Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【设计实验】(1)小玲取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想 一定不成立,其中一定发生反应的化学方程式为 .
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到 现象,得出猜想③成立.
Ⅱ.定量探究:
【提出问题】该红色粉末中氧化铁的质量分数是多少呢?
【设计实验】小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验.开始时缓缓通入CO气体,过一段时间后再加热至高温使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
(1)A装置中发生反应的化学方程式为 .
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为 .
(3)从环保角度看上述装置有严重不足之处.你认为应该如何改进? .
Ⅲ.拓展延伸
【提出问题】实验后B装置洗气瓶内溶液中的溶质是什么呢?
【设计实验】小华同学取该洗气瓶内溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,共用去稀盐酸60克,所得溶液质量为107.8克.通过计算回答:
(1)生成二氧化碳 克.
(2)从洗气瓶内取出的50克溶液中碳酸钠的质量是多少?(请写出计算过程)
(3)Ⅱ中定量实验结束后洗气瓶内溶液中的溶质是 .
