题目内容
【题目】实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图所示.请回答下列问题:
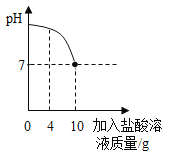
(1)当pH为4时溶液中的溶质是_____;
(2)计算当pH刚好为7时所得溶液的溶质质量分数._____(写出计算过程)
【答案】HCl和NaCl 6.5%
【解析】
(1)当pH为4时,溶液显酸性,所以盐酸过量,盐酸和氢氧化钠反应生成氯化钠和水,所以溶液中的溶质是HCl和NaCl,故填HCl和NaCl。
(2)通过图象可以看出,恰好完全反应,消耗的盐酸是10g,参加反应的氢氧化钠的质量为8g×10%=0.8g
设生成氯化钠为x
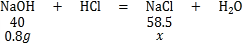
40:58.5=0.8g:x
x=1.17g
反应后所得溶液的溶质质量分数为![]() ×100%=6.5%
×100%=6.5%
答:(1)当pH为4时溶液中的溶质是HCl和NaCl;
(2)当pH刚好为7时所得溶液的溶质质量分数6.5%。

 名校课堂系列答案
名校课堂系列答案【题目】学校化学兴趣小组同学为测定野外采集到的石灰石中碳酸钙的质量分数。称取10.0g 的石灰石样品,把 100g 稀盐酸分 5 次加入样品中(假设杂质不反应也不溶解),得实验数据如下
滴加次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
稀盐酸的用量/g | 20 | 20 | 20 | 20 | 20 |
剩余固体质量/g | 7.5 | x | 2.5 | 2.0 | 2.0 |
请计算:
(1)表中 x 的数值是________;
(2)这种石灰石样品中碳酸钙的质量分数是________;
(3)这些样品完全反应共产生气体的质量是多少_________?(写出规范的计算过程)
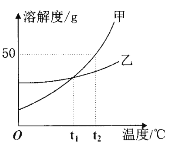
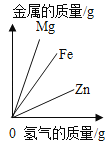
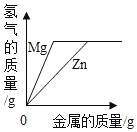
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D