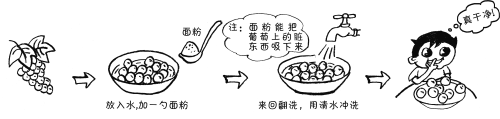
题目内容
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾某些性质进行研究。
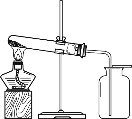
Ⅰ.不稳定性
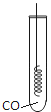
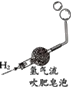
(1)如图所示进行实验,KMnO4受热分解的化学方程式为_______。
(2)用向上排空气法收集O2的原因是______。
Ⅱ.腐蚀性
(查阅资料)
(1)KMnO4溶液呈中性、有腐蚀性。
(2)常温下铜片不和稀硫酸反应。
(进行实验)
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
编号 | ① | ② | ③ | ④ | |
实验 |
|
|
|
| |
铜片 质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
(解释与结论)
(3)实验1的目的是_______。
(4)实验2中,通过对比②和④,得出的结论是_______。
(5)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比____(填编号)。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。
5Cu + 2KMnO4 + 8H2SO4 === 5CuSO4 + 2MnSO4 + K2SO4 + _______
【答案】2KMnO4 ![]() K2MnO4 + MnO2 + O2↑ 氧气的密度比空气略大 探究高锰酸钾溶液浓度与鸡皮被腐蚀程度的关系 其他条件相同时(在高锰酸钾溶液的体积、浓硫酸滴数、铜片的质量、反应时间相同的条件下),酸性高锰酸钾溶液浓度越高对铜的腐蚀性越强 ①②③ 8H2O
K2MnO4 + MnO2 + O2↑ 氧气的密度比空气略大 探究高锰酸钾溶液浓度与鸡皮被腐蚀程度的关系 其他条件相同时(在高锰酸钾溶液的体积、浓硫酸滴数、铜片的质量、反应时间相同的条件下),酸性高锰酸钾溶液浓度越高对铜的腐蚀性越强 ①②③ 8H2O
【解析】
(1)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式为:2KMnO4![]() K2MnO4 +MnO2+O2↑;
K2MnO4 +MnO2+O2↑;
(2)氧气的密度比空气大,所以可用向上排空气法来收集氧气;
(3)实验1中,随着高锰酸钾浓度的不断增大,鸡皮被腐蚀的越来越严重,因此目的是探究不同浓度的高锰酸钾溶液腐蚀性强弱;
(4)实验2中通过对比②和④,得出的结论是酸性条件下高锰酸钾浓度越高,腐蚀性越强;
(5)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比①②③,通过对比①②可知,高锰酸钾在酸性条件下才具有腐蚀性,通过对比②③可知,只有酸性溶液不具有腐蚀性,通过对比①②③可知,KMnO4和硫酸共同作用对铜才有腐蚀性
(6)由质量守恒定律可知,反应前后铜原子都是5个,钾原子都是2个,锰原子都是2个,硫原子都是8个,反应前氢原子是16个,反应后应该是16个,反应前氧原子是40个,反应后应该是40个,其中8个包含在未知物质中,因此反应的化学方程式为:5Cu+2KMnO4+8H2SO4=5CuSO4+2MnSO4+K2SO4+8H2O。

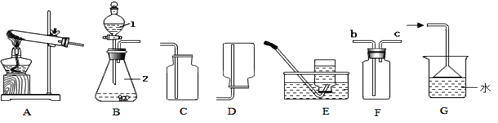
【题目】下列实验设计不能达到实验目的是( )
选项 | A | B | C | D |
实验设计 |
|
|
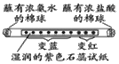
| 信息:氨水能使湿润 紫色石蕊试纸变蓝; 盐酸能使湿润紫色 石蕊试纸变红
|
实验 目的 | 红磷燃烧测定空气中氧气的含量 | 探究石蜡燃烧后有二氧化碳生成 | 验证氢气的密度比空气小 | 不同分子运动速率 |
A. A B. B C. C D. D