题目内容
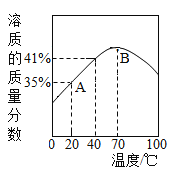
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列说法正确的是
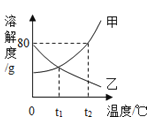
A.t2℃时,向100g甲中加入100g水后形成溶液的质量为200g
B.t1℃时,甲、乙两种物质的溶解度相等
C.甲的溶解度比乙大
D.将t2℃时甲、乙的饱和溶液分别降到t1℃时,两溶液的溶质质量分数相等
【答案】B
【解析】
试题分析:由溶解度曲线可知,t2℃时甲的溶解度为80g,即该温度下100g溶剂中最多溶解80g甲达到饱和状态,故t2℃时将100g甲加入到100g水中形成的的溶液的质量为180g,A错误;t1℃时甲乙相交,即t1℃时甲乙的溶解度相等,B正确;比较溶解度的大小要指明温度,C错误;甲的溶解度随温度的升高而增大,故降温后甲的饱和溶液中有晶体析出,溶质的质量分数减小,乙的溶解度随温度的升高而减小,故降温后乙的溶解度变大,溶液由饱和溶液变成不饱和溶液,溶质的质量分数不变,故从t2℃降温到t1℃甲乙的溶质质量分数不相等,D错误。故选B。

 优百分课时互动系列答案
优百分课时互动系列答案【题目】在学习酸、碱、盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的探究。

探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,②是CaCl2。
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴入 | 溶液变红 | 猜想①正确 |
探究二:过滤后澄清滤液中会有哪些溶质?
【提出猜想】
猜想一:NaOH和Na2CO3;
猜想二: ;
猜想三:NaOH.
(3)【实验验证】同学们针对“猜想一”进行如下实验:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | “猜想一”不成立 |
他们的实验结论是否正确? (填“是”或“否”)
(4)【继续探究】设计如下实验方案确定滤液中溶质的组成.
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
“猜想二”成立 | ||
若A、B中都没有沉淀产生 | “猜想三”成立 |
(5)【反思与拓展】
①为防止标签被腐蚀而破损,倾倒液体时 。
②在分析反应后所得溶液中溶质时,除考虑可溶性的生成物,还应考虑 。