题目内容
【题目】下列关于氧气的说法正确的是
A.氧气能支持燃烧,可以做燃料
B.氧气能与所有的物质发生氧化反应
C.水中能溶解一定量的氧气,因此水中生物能赖以生存
D.缓慢氧化与燃烧一样,会伴随着发光、放热的现象
【答案】C
【解析】
试题分析:氧气能支持燃烧,但不能做燃料;氧气能与大多数的物质发生氧化反应;水中能溶解一定量的氧气,因此水中生物能赖以生存;缓慢氧化与燃烧一样,不一定会伴随着发光、放热的现象。故选C.

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某小组同学用不同长度的光亮镁条分别与4 mL 5%的稀盐酸反应,实验现象记录如下。
试管 | A | B | C | D |
镁条长度 | 1 cm | 2 cm | 3 cm | 4 cm |
实验现象 | 产生大量气泡,镁条溶解 | |||
无沉淀 | 少量灰白色沉淀 | 较多量灰白色沉淀 | 大量灰白色沉淀 | |
【提出问题】灰白色沉淀是什么?实验中为什么出现了灰白色沉淀?
【查阅资料】氢氧化镁[Mg(OH)2]难溶于水,Mg(OH)2 ![]() MgO + H2O
MgO + H2O
【猜想与假设】
Ⅰ. 灰白色沉淀可能是析出的氯化镁。
Ⅱ. 灰白色沉淀可能是生成的氢氧化镁。
【进行实验】
实验 | 实验操作 | 实验现象 |
1 | ① 取一定量上述实验中灰白色沉淀放入试管中,然后加入 5mL 蒸馏水,振荡、静置 ② 取等量氯化镁固体放入另一支试管中,加5mL蒸馏水,振荡 | ① 中固体量未减少 ② 中固体全部溶解得到澄清溶液 |
2 | 取上述实验中灰白色沉淀,用蒸馏水洗涤、室温晾干,放入试管中进行加热,试管口用湿润的紫色石蕊试纸检验 | 紫色石蕊试纸变红 |
3 | ① 在1支试管放入一小段光亮的镁条,加入 5mL 蒸馏水 ② 再向试管中加入几滴氯化镁饱和溶液 | ① 中无明显现象 ② 中镁条表面立即持续产生细小气泡并不断溶解,一段时间后镁条全部溶解,有大量灰白色沉淀 |
实验4:测定反应过程中溶液的pH变化。
在小烧杯中放入约 50 mL 质量分数为0.5% 稀盐酸,然后加入10 cm 光亮的镁条,现象及数据如下表所示。
时间/min | 0 | 48 | 77 | 85 | 87 | 95 | 100 |
溶液pH | 2 | 3 | 5.2 | 7.2 | 8.6 | 9.1 | 10.6 |
实验现象 | 大量气泡 | 镁条表面变暗,气泡减小 | 镁条表面变灰,有沉淀生成,并逐渐增多 | ||||
【解释与结论】
(1)试管A中,镁与稀盐酸反应的化学方程式为_______。
(2)猜想与假设Ⅰ不成立,其原因是_______。
(3)根据上述实验得出的下列结论中,正确的是________(填序号)。
A.灰白色固体不是氢氧化镁
B.镁条的用量偏多导致沉淀产生
C.灰白色固体受热产生酸性物质
(4)根据实验4,你认为产生灰白色沉淀的条件是________。
【反思与评价】
(5)经过进一步实验,灰白色沉淀中含有镁、氯、氢、氧四种元素。实验3中产生灰白色沉淀是因为镁与________反应生成的。
(6)通过本实验,今后再遇到化学反应中的异常现象时,可以从______角度分析原因(答出一条即可)。
【题目】实验室常用下列装置来制取、收集气体.仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题.
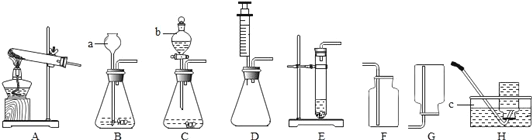
(1)仪器a、c的名称是:a______,c____________.
(2)实验室用KMnO4制取02,应选用的发生装置和收集装置的组合为____________(填字母序号),该发生装置的不足之处是____________,该反应的化学方程式是____________.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有____________(填数字序号)
①易溶于水 ②难溶于水 ③不与水反应 ④密度与空气接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入下表,并用简单的实验进行验证:
可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
原因:______ | _______ | _____ | 猜想的结论正确 |
(4)化学反应可控制才能更好地为人类造福,我们可以通过改变反应的条件、药品用量、改进装置等途径来达到控制反应的目的。常温下块状电石(CaC2)与水反应生成乙炔 (C2H2)气体和氢氧化钙,该反应的化学方程式是____________,实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.图中适合制取乙炔气体的发生装置有____________(填装置序号)。
