题目内容
我们家里常用纯碱来蒸馒头,纯碱的主要成分是Na2CO3,纯碱样品中含有少量的氯化钠.某实验小组要测定该纯碱中碳酸钠(Na2CO3)的质量分数.现取该纯碱样品6g于烧杯中,逐滴加入10%的稀盐酸至不再产生气泡为止,使之恰好完全反应,共收集到2.2g二氧化碳气体,其反应的化学方程式为:Na2CO3+2HCl→2NaCl+H2O+CO2↑.试计算:(最终计算结果保留一位小数)
(1)纯碱样品中碳酸钠的质量分数(写出计算过程).
(2)若用溶质质量分数为37%、密度为1.18g/cm3的浓盐酸,配制上述反应所需用量的10%的稀盐酸,需此浓盐酸 mL.
(3)反应后所得氯化钠溶液的溶质质量分数为(写出计算式即可). .
【答案】分析:(1)根据二氧化碳的质量以及碳酸钠与盐酸反应的方程式,列比例式即可求得参加反应的碳酸钠的质量以及反应生成的氯化钠的质量;
(2)根据碳酸钠与盐酸反应的化学方程式计算出所需HCl的质量,然后计算出浓盐酸的体积.
(3)由(1)求得反应生成的氯化钠的质量,则氯化钠的总质量为反应生成的氯化钠加上样品中原来有的氯化钠;
根据质量守恒定律求得反应后溶液的质量;再根据溶质质量分数=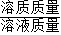 ×100%即可求得反应后所得氯化钠溶液的溶质质量分数.
×100%即可求得反应后所得氯化钠溶液的溶质质量分数.
解答:解:(1)设原混和物中碳酸钠的质量为x,生成NaCl的质量为y,参加反应的HCl为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 2.2g
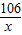 =
=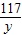 =
=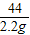 =
=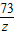 ;
;
解得:x=5.3g,y=5.85g,z=3.65g
则碳酸钠的质量分数为: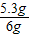 ×100%═88.3%
×100%═88.3%
(2)设配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm3的浓盐酸的体积为a,则a×1.18g/cm3×37%=3.65g
则a=8.36ml
(3)参加反应的盐酸溶液的质量为: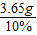 =36.5g.
=36.5g.
反应后的溶质质量为:反应生成的氯化钠加上样品中原来有的氯化钠,样品中原有的氯化钠质量为:6-5.3=0.7g,反应生成的氯化钠为:5.85g
则溶质的质量为:5.85+0.7=6.55g
根据质量守恒定律,溶液的质量为:36.5g+5.3g-2.2g=39.6g
则溶质的质量分数为: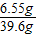 ×100%
×100%
答:纯碱样品中碳酸钠的质量分数88.3%,配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm3的浓盐酸的体积为8.36ml,
所得氯化钠溶液的溶质质量分数为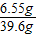 ×100%
×100%
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.
(2)根据碳酸钠与盐酸反应的化学方程式计算出所需HCl的质量,然后计算出浓盐酸的体积.
(3)由(1)求得反应生成的氯化钠的质量,则氯化钠的总质量为反应生成的氯化钠加上样品中原来有的氯化钠;
根据质量守恒定律求得反应后溶液的质量;再根据溶质质量分数=
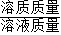 ×100%即可求得反应后所得氯化钠溶液的溶质质量分数.
×100%即可求得反应后所得氯化钠溶液的溶质质量分数.解答:解:(1)设原混和物中碳酸钠的质量为x,生成NaCl的质量为y,参加反应的HCl为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 2.2g
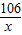 =
=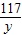 =
=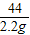 =
=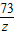 ;
;解得:x=5.3g,y=5.85g,z=3.65g
则碳酸钠的质量分数为:
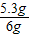 ×100%═88.3%
×100%═88.3%(2)设配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm3的浓盐酸的体积为a,则a×1.18g/cm3×37%=3.65g
则a=8.36ml
(3)参加反应的盐酸溶液的质量为:
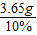 =36.5g.
=36.5g.反应后的溶质质量为:反应生成的氯化钠加上样品中原来有的氯化钠,样品中原有的氯化钠质量为:6-5.3=0.7g,反应生成的氯化钠为:5.85g
则溶质的质量为:5.85+0.7=6.55g
根据质量守恒定律,溶液的质量为:36.5g+5.3g-2.2g=39.6g
则溶质的质量分数为:
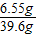 ×100%
×100%答:纯碱样品中碳酸钠的质量分数88.3%,配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm3的浓盐酸的体积为8.36ml,
所得氯化钠溶液的溶质质量分数为
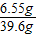 ×100%
×100%点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.

练习册系列答案
相关题目