题目内容
实验室制下列三种气体
A.O2:2KClO3
2KCl+3O2↑
B.CO2:
C.Cl2:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
说明:Cl2是一种黄绿色、有刺激性气味、密度比空气大、能溶于水的气体.
(1)写出制CO2的反应方程式.
(2)有下列三种制气装置(如图甲)和两种集气装置(如图乙)
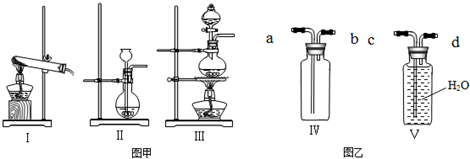
①制取CO2应选取的装置是 ,应选用Ⅲ装置制取的气体是 ;
②用Ⅳ装置收集Cl2应从 口进气,上述三种气体中,能用Ⅴ装置收集的气体有 ,应从 口进气.
(3)A中制O2后,从剩余固体中分离出MnO2的操作有 (不需烘干),所用到的玻璃仪器有 .
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,理论上能制得Cl2的质量为 g,而实际收集到的Cl2质量远远小于这个数值,若操作正确,装置不漏气,则可能的原因有(至少两点)
(5)将8g KClO3与1g MnO2混合加热制O2,充分反应后冷却,称得试管内剩余固体质量为4.2g,
①请用两种方法求生成KCl的质量
②计算结果表明,题目数据有问题,要使该题数据合理,可将KClO3质量由8g改为a g,则a的取值范围是 .
A.O2:2KClO3
| ||
B.CO2:
C.Cl2:MnO2+4HCl(浓)
| ||
说明:Cl2是一种黄绿色、有刺激性气味、密度比空气大、能溶于水的气体.
(1)写出制CO2的反应方程式.
(2)有下列三种制气装置(如图甲)和两种集气装置(如图乙)

①制取CO2应选取的装置是
②用Ⅳ装置收集Cl2应从
(3)A中制O2后,从剩余固体中分离出MnO2的操作有
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,理论上能制得Cl2的质量为
(5)将8g KClO3与1g MnO2混合加热制O2,充分反应后冷却,称得试管内剩余固体质量为4.2g,
①请用两种方法求生成KCl的质量
②计算结果表明,题目数据有问题,要使该题数据合理,可将KClO3质量由8g改为a g,则a的取值范围是
分析:(1)据实验室制取二氧化碳的反应原理书写方程式;
(2)①据实验室制取二氧化碳、氯气的反应物的状态和反应条件选择发生装置;
②排水法收集不溶于水或不易溶于水的气体,氯气和二氧化碳能溶于水,故不能用排水法收集,利用排水法收集时,要从短管进气,长管便于排水;
(3)氯化钾易溶于水,二氧化锰不溶于水,所以从剩余固体中分离出MnO2可用过滤的方法,并据过滤所用仪器回答;
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,二氧化锰足量,说明盐酸完全反应,据盐酸的质量和方程式可计算出生成氯气的质量;实际收集到的Cl2质量远远小于这个数值,若操作正确,装置的气密性没有问题,可能是容器内残留一部分氯气或收集时部分氯气逸出导致,及二氧化锰与浓盐酸反应,与稀盐酸不反应引起的;
(5)①氯酸钾充分反应,可据氯酸钾的质量及方程式计算氯化钾的质量;据质量守恒定律可知,固体质量的减少就是生成的氧气的质量,据氧气质量并结合方程式计算也可;
②计算氯酸钾的取值范围,可利用极值法分析,假设氯酸钾完全分解和未分解两种情况进行判断.
(2)①据实验室制取二氧化碳、氯气的反应物的状态和反应条件选择发生装置;
②排水法收集不溶于水或不易溶于水的气体,氯气和二氧化碳能溶于水,故不能用排水法收集,利用排水法收集时,要从短管进气,长管便于排水;
(3)氯化钾易溶于水,二氧化锰不溶于水,所以从剩余固体中分离出MnO2可用过滤的方法,并据过滤所用仪器回答;
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,二氧化锰足量,说明盐酸完全反应,据盐酸的质量和方程式可计算出生成氯气的质量;实际收集到的Cl2质量远远小于这个数值,若操作正确,装置的气密性没有问题,可能是容器内残留一部分氯气或收集时部分氯气逸出导致,及二氧化锰与浓盐酸反应,与稀盐酸不反应引起的;
(5)①氯酸钾充分反应,可据氯酸钾的质量及方程式计算氯化钾的质量;据质量守恒定律可知,固体质量的减少就是生成的氧气的质量,据氧气质量并结合方程式计算也可;
②计算氯酸钾的取值范围,可利用极值法分析,假设氯酸钾完全分解和未分解两种情况进行判断.
解答:解:(1)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,同时生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)①实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,属于固液常温型,故制取CO2应选取Ⅱ;Ⅲ装置适用于固体和液体加热制取气体,根据三种气体的反应原理可知,实验室用二氧化锰和浓盐酸加热制取氯气可用此装置;
②排水法收集不溶于水或不易溶于水的气体,氯气和二氧化碳能溶于水,故不能用排水法收集,利用排水法收集时,要从短管进气,长管便于排水;
(3)氯化钾易溶于水,二氧化锰不溶于水,所以从剩余固体中分离出MnO2可用过滤的方法,先溶解再过滤;过滤时所用的玻璃仪器有烧杯、玻璃棒、漏斗;
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,二氧化锰足量,说明盐酸完全反应,参加反应的盐酸溶质的质量是:100g×36.5%=36.5g;
设理论上能制得Cl2的质量为x
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
146 71
36.5g x
=
x=17.75g
实际收集到的Cl2质量远远小于这个数值,若操作正确,装置的气密性没有问题,可能是容器内残留一部分氯气或收集时部分氯气逸出导致;浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,加热时部分HCl挥发,同时反应消耗氯化氢,并生成水,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不与MnO2反应,所以氯气的质量偏小,还可能是此原因;
(5)①方法1:生成氧气的质量为:8g+1g-4.2g=4.8g;
设生成氯化钾的质量为x,
2KClO3
2KCl+3O2↑
149 96
x 4.8g
∴
=
解得:x=7.45g;
方法2:
据题意:氯酸钾和二氧化锰混合充分反应完全,则氯酸钾完全分解,设生成氯化钾的质量为y
2KClO3
2KCl+3O2↑
245 149
8g y
=
解得y≈4.9g
②所剩固体的质量=4.2g<7.45g,也小于4.9g,所以题目有错误;
如果完全反应后剩余固体质量为4.2g,则生成的氯化钾的质量是 4.2g-1g=3.2g
设氯酸钾质量为b,
2KClO3
2KCl+3O2↑
245 149
b 3.2g
=
解得:y≈5.3g;
假设氯酸钾没有反应,则其质量为:4.2g-1g=3.2g.
由于氯酸钾一定会分解,只是分解完全与否的问题,所以氯酸钾质量一定大于3.2g.故a的取值范围是:3.2g<a≤5.3g;
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)①Ⅱ;Cl2;②a;O2;d;
(3)溶解、过滤;烧杯、玻璃棒、漏斗;
(4)17.75;容器内有残留的部分氯气没有排出来;随着反应进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止(合理均可);
(5)①方法1:生成氯化钾的质量是7.45g,方法2:生成氯化钾的质量是4.9g;
②3.2g<a≤5.3g.
(2)①实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,属于固液常温型,故制取CO2应选取Ⅱ;Ⅲ装置适用于固体和液体加热制取气体,根据三种气体的反应原理可知,实验室用二氧化锰和浓盐酸加热制取氯气可用此装置;
②排水法收集不溶于水或不易溶于水的气体,氯气和二氧化碳能溶于水,故不能用排水法收集,利用排水法收集时,要从短管进气,长管便于排水;
(3)氯化钾易溶于水,二氧化锰不溶于水,所以从剩余固体中分离出MnO2可用过滤的方法,先溶解再过滤;过滤时所用的玻璃仪器有烧杯、玻璃棒、漏斗;
(4)用100g 36.5%的浓盐酸与足量MnO2混合加热,二氧化锰足量,说明盐酸完全反应,参加反应的盐酸溶质的质量是:100g×36.5%=36.5g;
设理论上能制得Cl2的质量为x
MnO2+4HCl(浓)
| ||
146 71
36.5g x
| 146 |
| 71 |
| 36.5g |
| x |
x=17.75g
实际收集到的Cl2质量远远小于这个数值,若操作正确,装置的气密性没有问题,可能是容器内残留一部分氯气或收集时部分氯气逸出导致;浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,加热时部分HCl挥发,同时反应消耗氯化氢,并生成水,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不与MnO2反应,所以氯气的质量偏小,还可能是此原因;
(5)①方法1:生成氧气的质量为:8g+1g-4.2g=4.8g;
设生成氯化钾的质量为x,
2KClO3
| ||
| △ |
149 96
x 4.8g
∴
| 149 |
| 96 |
| x |
| 4.8g |
解得:x=7.45g;
方法2:
据题意:氯酸钾和二氧化锰混合充分反应完全,则氯酸钾完全分解,设生成氯化钾的质量为y
2KClO3
| ||
| △ |
245 149
8g y
| 245 |
| 149 |
| 8g |
| y |
解得y≈4.9g
②所剩固体的质量=4.2g<7.45g,也小于4.9g,所以题目有错误;
如果完全反应后剩余固体质量为4.2g,则生成的氯化钾的质量是 4.2g-1g=3.2g
设氯酸钾质量为b,
2KClO3
| ||
| △ |
245 149
b 3.2g
| 245 |
| b |
| 149 |
| 3.2g |
解得:y≈5.3g;
假设氯酸钾没有反应,则其质量为:4.2g-1g=3.2g.
由于氯酸钾一定会分解,只是分解完全与否的问题,所以氯酸钾质量一定大于3.2g.故a的取值范围是:3.2g<a≤5.3g;
故答案为:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)①Ⅱ;Cl2;②a;O2;d;
(3)溶解、过滤;烧杯、玻璃棒、漏斗;
(4)17.75;容器内有残留的部分氯气没有排出来;随着反应进行,盐酸浓度变小,MnO2与稀盐酸不反应,该反应停止(合理均可);
(5)①方法1:生成氯化钾的质量是7.45g,方法2:生成氯化钾的质量是4.9g;
②3.2g<a≤5.3g.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目



