��Ŀ����
����Ŀ��ʯ��ʯ�������������й㷺����;��
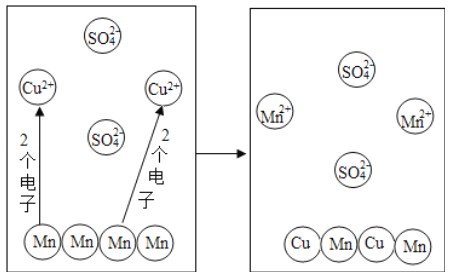
��1������ʯ��ʯ���Ƶû���CaO����Ӧ�Ļ�ѧ����ʽΪ___________________��
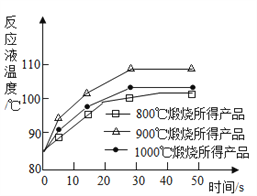
��2��Ϊ�ⶨ��ͬ�����¶ȶ�CaO���Ե�Ӱ�죬ȡʯ��ʯ��Ʒ��Ϊ���ȷ֣���ͬһ�豸�зֱ���800�桢900���1000�����������գ����ù���ֱ����������ˮ��ȫ��Ӧ����÷�ӦҺ�¶���ʱ��ı仯����ͼ��ʾ����֪��CaO��ˮ��Ӧ��_________��������ų��������ա����������¶��У�______����������CaO������ߡ�Ҫ�ó���ȷ���ۣ�����ʱ������Ƶ�������________ ��
��3���Ե�ʯ������Ҫ�ɷ�ΪCa(OH)2������������MgO�����ʣ�Ϊԭ���Ʊ��ߴ�CaCO3���������£�
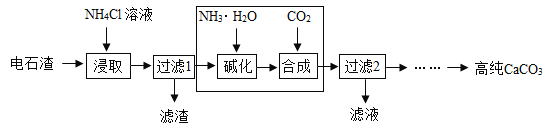
����ͼΪNH4ClŨ�ȶԸơ�þ�����ʵ�Ӱ�죺
��������=![]() ��100%��
��100%��
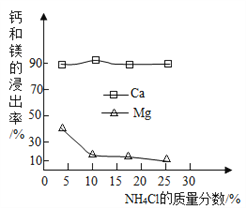
��֪�������˵�NH4Cl��Һ����������Ϊ________����ȡʱ��Ҫ��Ӧ�Ļ�ѧ����ʽΪ________________
�������з����ڲ���������_______________��Һ���ѧʽ������һ���õ���ԭ������ȫ��ͬ�������
�������з����ڲ���������Na2CO3��Һ��Ҳ�ܵõ��ߴ�CaCO3���Դ�������ĽǶȷ���ԭ���̵��ŵ㣺
a��NH3��ѭ�����ã��о� b��________________��
���𰸡� ![]() �ų� 900 ���յ�ʱ��
�ų� 900 ���յ�ʱ�� ![]() 10% NH4HCO3 ���Եõ�������Ʒ�Ȼ���
10% NH4HCO3 ���Եõ�������Ʒ�Ȼ���
����������1������ʯ��ʯ�Ļ�ѧ����ʽΪ��CaCO3����CaO+CO2�� ��2�����ݷ�ӦҺ���¶ȿ�֪��CaO��ˮ��Ӧ��ų�������900�淴ӦҺ���¶���ߣ�����������CaO������ߡ�Ҫ�ó���ȷ���ۣ�����ʱ������Ƶ�����������ʱ������3����NH4Cl��Һ����������Ϊ10%ʱ���ƵĽ����ʸߣ���ȡʱ��Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2NH4Cl+ Ca(OH)2==CaCl2+2H2O+2NH3����Ԫ�ص�����䡣�ۿ��Եõ�������Ʒ�Ȼ��ơ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Ϊ�ⶨij����������淋Ĵ��ȣ��������������Ƿ�����ͼ��ǩ�����С��ȡһ�����õ�����Ʒ���ձ��������Һ�������Ȼ�����Һ��Ӧ����¼�й����������

��Ӧǰ | ��Ӧ�� | |
�ձ�����Ʒ��Һ������ | �Ȼ�����Һ���� | ���˺��ձ�����Һ����������Һ����ʧ���Բ��ƣ� |
45g | 55g | 76.7g |
��Ӧ�Ļ�ѧ����ʽΪ��NH4��2SO4+BaCl2�TBaSO4��+2NH4Cl�������ɷ�������ˮ�����μӷ�Ӧ��
��1����Ӧ������BaSO4������Ϊ g��
��2������ȡ������Ʒ������Ϊ15g����ͨ������ȷ������������淋Ĵ����Ƿ����ǩ���������д��������̣�
��3����Ӧǰ����Һ����Ԫ�ص����� ������䡱��������С��������ԭ���� ��