题目内容
【题目】小明同学取14%的硫酸溶液70g于烧杯中,然后向烧杯中慢慢加入10g氧化铜粉末并不断搅拌,测得烧杯中溶液的质量与加入氧化铜粉末的质量关系如图所示。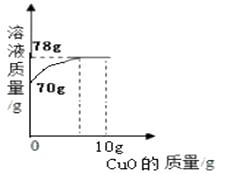
求:
(1)完全反应时共消耗氧化铜的质量为g;
(2)配制14%的硫酸溶液70g,需要98%的硫酸溶液g;
(3)反应后所得溶液中溶质的质量分数为多少?(写出计算过程,最后结果保留到小数点后1位)
【答案】
(1)8
(2)10
(3)解:设生成硫酸铜的质量为x。
CuO + | H2SO4 = | CuSO4+H2O |
80 | 98 | 160 |
8g | x |
![]()
x = 16g
反应所得溶液中溶质的质量分数= 16g÷78g×100% =20.5%
答: 反应所得溶液中溶质的质量分数为20.5%。
【解析】根据质量守恒定律知(1)完全反应时共消耗氧化铜的质量为78g-70g=8g. (2)配制14%的硫酸溶液70g,需要98%的硫酸溶液质量为x
70g×14%=98%×x,x=10g.(3)反应后所得溶液中溶质的质量分数为
解:设生成硫酸铜的质量为x。
CuO + | H2SO4 = | CuSO4+H2O |
80 | 98 | 160 |
8g | x |
![]() =
= ![]() ,x=16g.
,x=16g.
反应后所得溶液中溶质的质量分数为 ![]() ×100%=20.5%.
×100%=20.5%.
答∶(1)完全反应时共消耗氧化铜的质量为8g.(2)配制14%的硫酸溶液70g,需要98%的硫酸溶液是10g.⑶反应所得溶液中溶质的质量分数为20.5%。
点睛∶本题主要考查质量守恒定律的应用和根据化学方程式进行计算。
(1)由氧化铜和硫酸反应生成硫酸铜和水这个反应可知,反应后溶液质量增加的量就是氧化铜的质量
(2)利用氧化铜的质量结合化学方程式可计算硫酸铜的质量,溶质质量分数=溶质质量![]() 溶液质量×100%
溶液质量×100%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

