题目内容
【题目】点燃10gH2和O2的混合物气体,爆炸后,生成4.5g水,求原混合气体中H2、O2的质量分别为( )
A. H25g O25g B. H26g O24g C. H20.5g O29.5g D. H24g,O26g
【答案】BC
【解析】因为生成了4.5g水,则说明参加反应的混合气体总质量也为4.5g,而原气体总质量为10g。所以还有5.5g气体没有反应,可能是H2,也有可能是O2。根据化学方程式,分别计算出两种情况下原混合气体中H2和O2的质量,进行比较即可。①假设氢气完全反应,设原混合气体中H2质量为![]() , 2H2+O2
, 2H2+O2![]() 2H2O
2H2O
4 36
![]() 4.5g
4.5g
![]()
解之得: ![]() =0.5g,则原混合气体中O2的质量为10g-0.5g=9.5g;②假设氧气完全反应,设原混合气体中O2的质量为
=0.5g,则原混合气体中O2的质量为10g-0.5g=9.5g;②假设氧气完全反应,设原混合气体中O2的质量为![]() , 2H2+O2
, 2H2+O2![]() 2H2O
2H2O
32 36
![]() 4.5g
4.5g
![]() ,解之得:
,解之得: ![]() =4g,则原混合气体中H2的质量为10g-4g=6g。故选BC。
=4g,则原混合气体中H2的质量为10g-4g=6g。故选BC。

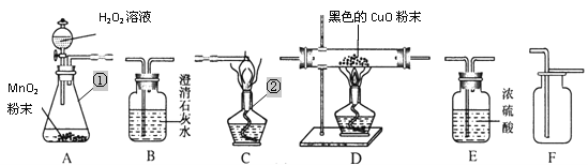
【题目】用如下图所示装置,在常温下,进行研究空气中氧气含量的实验。
内容 | 【实验】测定空气中氧气含量 |
实验 步骤 | 燃烧匙中放足量白磷,烧杯中盛放足量水,用激光手电照射白磷,白磷燃烧起来。待白磷熄灭,冷却至室温后,打开弹簧夹,观察到______。 |

(1)实验前检查装置气密性:打开弹簧夹,向烧杯中加水至液面浸没下端导管口,用手捂住广口瓶外壁,说明装置的气密性良好的现象是______________。
(2)补全实验中的实验现象。
【题目】下图为甲、乙两种物质的溶解度曲线。
资料:常温(20 ℃)下,溶解度的相对大小。
溶解度/g | <0.01 | 0.01~1 | 1~10 | >10 |
一般称为 | 难溶 | 微溶 | 可溶 | 易溶 |
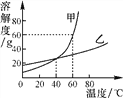
(1)常温下,乙属于________(填“易溶”“可溶”“难溶”或“微溶”)物质。
(2)________ ℃时,甲、乙两种物质的溶解度相等。
(3)60 ℃时,甲饱和溶液中溶质的质量分数为________。
(4)把60 ℃时质量相等的甲、乙饱和溶液降温到20 ℃,析出晶体较多的物质是________。
(5)要使乙的饱和溶液中溶质大量结晶析出,应该采用________的方法。
(6)若要从甲、乙的混合溶液中提纯甲,则主要操作是蒸发浓缩、________、________、干燥。
【题目】某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二:________________,猜想三:R>Al>Cu。
【查阅资料】R是一种银白色的金属,RSO4溶液呈蓝色;常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想 | 主要操作 | 主要现象 | 实验结论 |
一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一________(“成立”或“不成立”) |
二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 | 猜想二成立 |
三 | 把铝丝插入RSO4溶液中 | ________________ | 猜想三成立 |
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到RSO4溶液中,一段时间后,溶液的颜色由________色变为________色;进而确认猜想三不成立,猜想二成立。写出Al与稀硫酸反应的化学方程式:____________________________。
【归纳总结】探究结束后,他们总结得出:通过金属与酸反应或金属与盐溶液反应可以比较金属活动性强弱。