题目内容
下列关于空气的说法中,错误的是( )
A.空气中含有少量的稀有气体,它们可以制成多种用途的电光源
B.空气中分离出的氮气化学性质不活泼,食品包装中充氮气可以防腐
C.按质量计算,空气中约含氮气78%、氧气21%、稀有气体等其他成分1%
D.空气中的氧气化学性质比较活泼,在常温下能与许多物质发生化学反应
小雨阅读课外资料得知:过氧化氢分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣。
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列三组实验(其他可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | — | |
② | 1.2g | 氧化铜0.5g | |
③ | 1.2g | 二氧化锰0.5g |
(1)上述实验应测量的“待测数据”是_____。
(2)若实验②比实验①的“待测数据”更_____(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(3)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到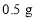 黑色粉末,说明_____。
黑色粉末,说明_____。
(4)再将黑色粉末放入试管中,加入_____,若观察到_____,说明黑色粉末的化学性质在反应前后保持不变。
(预期结论)氧化铜也能作氯酸钾分解的催化剂。
(评价设计)你认为小雨设计实验③和实验②对比的目的是_____。
盐酸硫酸和硝酸是三种常用的酸,为什么初中化学只介绍了盐酸和硫酸,没有介绍硝酸呢?兴趣小组同学在实验室发现一瓶硝酸,发现硝酸保存在棕色试剂瓶中,小组的同学对此产生了好奇,并对硝酸的部分性质进行如下探究。
[查阅资料]①棕色试剂瓶常用于保存见光易分解的物质;②NO是无色气体,能与空气中的氧气迅速反应生成NO2,NO2是红棕色气体,低温时转化成液体N2O4;③相同条件下,气体的体积比等于气体分子数目之比;④无水氯化钙可干燥NO、NO2、H2、O2等。
[提出问题]硝酸具有哪些化学性质?
[提出猜想]猜想一:硝酸不稳定,易分解;
猜想二:稀硝酸可与铁反应产生氢气;
猜想三:硝酸能与氢氧化钠反应。
[实验探究]
实验操作 | 实验现象 | 实验结论 | |
① | 取少量浓硝酸于试管中,用酒精灯加热 | 产生红棕色气体 | 猜想一正确 |
② | 向稀硝酸中加入少量铁粉 | 有气泡产生,气体在试管口由无色变为红棕色,铁粉逐渐溶解,得到黄色溶液 | 猜想二不正确 |
③ | 向稀硝酸中滴加氢氧化钠溶液 | 无明显现象 | 猜想三不正确 |
[交流讨论](1)小明认为铁与稀硝酸反应产生的气体是NO,他的依据是___________________。
(2)小江认为实验③的结论不严谨,他重新设计方案验证猜想三,请补充小江的实验报告:
实验操作 | 实验现象 | 实验结论 |
_______________。 | _______________。 | 猜想三正确 |
[继续探究]为验证硝酸分解的气体产物,在老师的指导下,小组同学设计如图装置:

[实验步骤] I.关闭K2,打开K,加热观察到有红棕色气体产生,当有红棕色气体由导管口a逸出时,将带火星的木条放在导管口a处,观察到木条复燃;
II.打开K2,关闭K1,一段时间后,试管1中出现无色液体,试管2中无明显现象,将带火星的木条放在导管口b处,观察到木条复燃。经进一步实验确认浓硝酸分解的产物有三种,则浓硝酸分解产生的气体为____________。
[知识拓展]小江分析上述实验后,认为二氧化氮具有助燃性,请说明理由_____________。


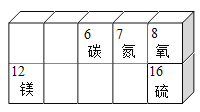
 、
、 都属于氧化物 B.
都属于氧化物 B. 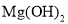 是一种难溶性碱
是一种难溶性碱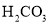 是一种稳定性酸 D.
是一种稳定性酸 D.  、
、 都属于盐
都属于盐