题目内容
【题目】生活中常见物质的性质、制法等是化学研究的重要内容。
(1)铁、铜、铝是人们广泛利用的三种金属,人类大规模开发利用这三种金属的先后顺序与下列_____(填序号)因素有关。
A 地壳中金属的含量 B 金属的活动性 C 金属的熔点
(2)铝的活动性比铁强,但铝为什么却能在空气中却表现出良好的抗腐蚀性?_____
(3)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是_____。
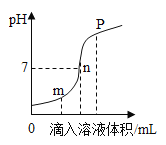
a.m点所示溶液为碱性 b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中溶质为NaCl和NaOH d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(4)某工厂将含有CuSO4、ZnSO4、FeSO4的废液,经重新处理回收有关金属和化合物,设计了如下工艺流程图,请据图回答:
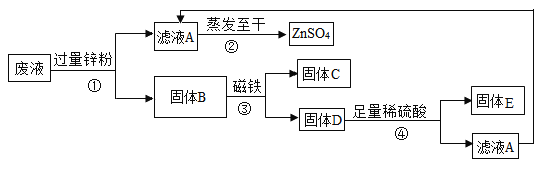
a.步骤①和④需要进行的操作是_____,固体B中一定含有的物质为_____。
b.请写出步骤④中发生反应的化学方程式:_____。
c.称取15g固体D放入烧杯中,向其中加入100g稀硫酸,恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为114.6g(不包括烧杯的质量且气体的溶解忽略不计)。试计算所得溶液中溶质的质量分数。_____
【答案】B 铝表面生成一层致密的氧化铝薄膜,隔绝内部的铝和外界的氧气 c 过滤 锌、铜、铁 Zn+H2SO4=ZnSO4+H2↑ 28.6%
【解析】
(1)①元素开发利用的先后顺序和金属活动性顺序有关,故选:B;
(2)铝在空气中却表现出良好的抗腐蚀性能,其原因是:通常情况下,铝能和空气中的氧气反应生成一层致密的氧化物薄膜,阻止铝进一步反应。
故填:铝表面生成一层致密的氧化铝薄膜,隔绝内部的铝和外界的氧气。
(3)a、m点时溶液的pH小于7,显酸性,故选项说法错误。
b、n点时溶液的pH等于7,显中性,n点所示溶液中加紫色石蕊溶液显紫色,故选项说法错误。
c、p点时溶液的pH大于7,显碱性,说明氢氧化钠溶液过量,所得溶液中的溶质为NaOH和NaCl,故选项说法正确。
d、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误。
故选:c。
(4)a、步骤①和④都是讲固体和液体分开,操作为过滤;锌可以置换硫酸铜中的铜,能与硫酸亚铁反应生成硫酸锌和铁,由于锌粉过量,所以锌会完全置换硫酸铜中的铜和硫酸亚铁中的铁,滤渣B中一定有铜、铁和锌;
故填:过滤;锌、铜、铁。
c、因为生成氢气的质量为15g+100g-114.6g=0.4g,故
设生成的硫酸锌的质量为x,参加反应的锌的质量为y。
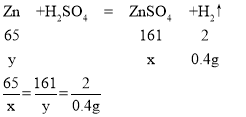
解得x=32.2g,y=13g
所得溶液中溶质的质量分数为:![]() ×100%=28.6%;
×100%=28.6%;
故填:28.6%。

【题目】研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
假设:过氧化氢生成氧气的快慢与催化剂种类有关
实验方案:常温下,在两瓶相同体积的过氧化氢溶液中分别加入相同质量二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间。
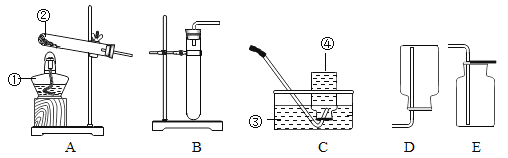
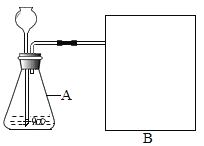
进行实验:如图是他们进行实验的装置,此实验中B处最宜采用的气体收集方法是:_______。
实验记录:
实验编号 | 1 | 2 |
反应物 | 6% 过氧化氢溶液 | 6%过氧化氢溶液 |
催化剂 | 1g红砖粉 | 1g 二氧化锰 |
时间 | 152s | 35s |
结论:该探究过程得出的结论是______________。
反思:过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰或红砖粉是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________和_______是否改变。
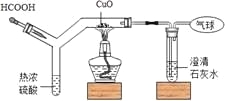
【题目】探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装 的是气体、固体或液体,当胶头滴管滴几滴液体后,能观察到气球变大的实验组合是( )

组合 | 滴管中 | 烧瓶中 |
A | HCl | Zn |
B | HCl | CaCO3 |
C | H2O | NH4NO3 |
D | H2SO4(浓) | H2O |
A. AB. BC. CD. D
【题目】如图是某同学做“粗盐的提纯”实验时的过滤装置图;
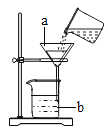
(1)写出标号的仪器名称:a _____,b ___________
(2)图中明显缺少一种玻璃仪器,请写出需要补充的仪器名称是_________,其作用______________。
(3)过滤后的滤液在进行蒸发时也要用到上述补充的仪器,这种仪器在蒸发过程中的作用是_________。
(4)某同学过滤完后发现滤液依然浑浊,除了滤纸可能破损以外,请你再写出一种造成滤液浑浊的原因_____________。
(5)“粗盐的提纯”实验步骤是:称量粗盐 、_________、__________、 __________、称量精盐、计算。称取5.0g粗盐,最终得到4.0g精盐,则精盐的产率是__________。(用百分数表示)
(6)各小组的产率及评价如下:
组别 | 1 | 2 | 3 | 4 |
产率 | 75% | 83% | 88% | 72% |
教师对产率的评价 | 偏低 | 偏高 | 偏高 | 偏低 |
下列各组同学对造成产率偏高或偏低的原因分析,正确的是_____(填编号)。
A第1组:烧杯里的食盐未溶解完就开始过滤
B第2组:蒸发时,有固体物质飞溅
C第3组:滤液浑浊就开始蒸发
D第4组:称量时,精盐中还含有水分
(7)为了鉴别食盐水和蒸馏水,甲同学认为可以用蒸发水分的方法。将所取的两种液体蒸干,留有固体物质的,对应的液体是食盐水;没有固体物质残留的,对应的液体是蒸馏水。他选用的一组仪器是________。
A试管、酒精灯、漏斗、玻璃棒
B酒精灯、蒸发皿、铁架台(带铁圈)、玻璃棒
C托盘天平、酒精灯、量筒、玻璃棒