题目内容
 某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算:
某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算:(1)用40%的浓硫酸(密度为1.30g/cm3)l0mL可配制2%的稀硫酸
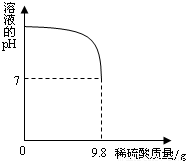
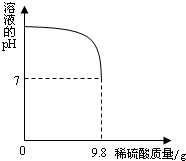
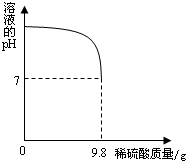
(2)向盛有20g废水的锥形瓶中逐滴滴加2%的稀硫酸,至恰好完全反应.将实验所得数据绘制成右图所示图象.求废水中氢氧化钾的质量分数?(反应的化学方程式为:2KOH+H2SO4═K2SO4+2H2O).
(3)请你设计实验证明处理后的废水PH=7:
分析:(1)稀释前后溶液中溶质的质量不变;
(2)根据相关数据和反应的化学方程式可以计算氢氧化钾的质量,进一步可以计算氢氧化钾的质量分数;
(3)用pH试纸可以测定溶液的pH.
(2)根据相关数据和反应的化学方程式可以计算氢氧化钾的质量,进一步可以计算氢氧化钾的质量分数;
(3)用pH试纸可以测定溶液的pH.
解答:解:(1)设可配制2%的稀硫酸的质量为x,
根据稀释前后溶液中溶质的质量不变,有:1.30g/cm3×l0mL×40%=x×2%=260g;
故填:260;
(2)解:设氢氧化钾的质量为y,
由图中数据可知,恰好完全反应时,消耗稀硫酸的质量是9.8g,
2KOH+H2SO4═K2SO4+2H2O,
112 98
y 9.8g
=
,
y=11.2g,
废水中氢氧化钾的质量分数为:
×100%=56%;
答:废水中氢氧化钾的质量分数为56%.
(3)证明处理后的废水PH=7的方法是:用洁净干燥的玻璃棒蘸取处理后的废水,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH=7.
故填:用洁净干燥的玻璃棒蘸取处理后的废水,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH=7.
根据稀释前后溶液中溶质的质量不变,有:1.30g/cm3×l0mL×40%=x×2%=260g;
故填:260;
(2)解:设氢氧化钾的质量为y,
由图中数据可知,恰好完全反应时,消耗稀硫酸的质量是9.8g,
2KOH+H2SO4═K2SO4+2H2O,
112 98
y 9.8g
| 112 |
| 98 |
| y |
| 9.8g |
y=11.2g,
废水中氢氧化钾的质量分数为:
| 11.2g |
| 20g |
答:废水中氢氧化钾的质量分数为56%.
(3)证明处理后的废水PH=7的方法是:用洁净干燥的玻璃棒蘸取处理后的废水,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH=7.
故填:用洁净干燥的玻璃棒蘸取处理后的废水,滴在pH试纸上,把变色的pH试纸与标准比色卡对照,即可得溶液的pH=7.
点评:测定溶液的pH时,选择的玻璃棒应该是洁净干燥的,如果带有杂质或附着有水,则会影响溶液pH的测定.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算:
某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算: