题目内容
在mg20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液的总质量为3mg.(1)计算所加硫酸镁溶液的质量分数;
(2)用N表示溶液中离子的数目,不同种离子用离子符号注明[如N(Na+)表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图.
【答案】分析:(1)原碱溶液的质量为mg,最后溶液质量为3mg,则溶液增加的质量为反应导致的溶液质量增加以及硫酸镁溶液中所含的水的质量,利用差量法来计算硫酸镁的质量,利用质量守恒来计算硫酸镁溶液的质量,最后计算质量分数;
(2)根据离子的反应来判断离子数目的变化,将所加硫酸镁溶液的质量的为横坐标,N表示离子数目为纵坐标来作图解答.
解答:解:(1)依据题意可知溶液的总质量增加了2mg,其中包括硫酸镁与氢氧化钠反应导致的溶液质量增加以及硫酸镁溶液中所含的水,则设氢氧化钠转化为硫酸钠导致的溶液质量增加量为x,硫酸镁的质量为y,
2NaOH+MgSO4═Na2SO4+Mg(OH)2↓△m
80 120 142 58 142-80=62
0.2m y x
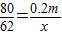 ,
,
解得:x=0.155mg,y=0.3mg,
硫酸镁溶液中所含的水的质量为2mg-0.155mg,
硫酸镁溶液的总质量为(0.3m+2m-0.155m)g,
则硫酸溶液中溶质的质量分数为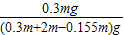 ×100%═13.99%,
×100%═13.99%,
答:所加硫酸镁溶液的质量分数13.99%.
(2)因钠离子不参加反应,在整个过程中其数目不随硫酸镁溶液的加入发生变化,即钠离子数目一直不变;
开始溶液中没有硫酸根离子,然后硫酸根离子随硫酸镁溶液的加入在不断增多,但是硫酸根离子浓度是钠离子浓度的一半.开始为氢氧化钠溶液,随硫酸镁溶液的加入,氢氧根离子和镁离子结合生成沉淀,至沉淀最多使氢氧根离子沉淀完全,则氢氧根离子接近为0;故答案为:
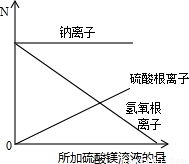
点评:本题难度较大,考查有关化学反应方程式的计算,学生应学会利用差量法进行相关计算,并注意在反应中离子是否参加反应来判断离子数目的变化.
(2)根据离子的反应来判断离子数目的变化,将所加硫酸镁溶液的质量的为横坐标,N表示离子数目为纵坐标来作图解答.
解答:解:(1)依据题意可知溶液的总质量增加了2mg,其中包括硫酸镁与氢氧化钠反应导致的溶液质量增加以及硫酸镁溶液中所含的水,则设氢氧化钠转化为硫酸钠导致的溶液质量增加量为x,硫酸镁的质量为y,
2NaOH+MgSO4═Na2SO4+Mg(OH)2↓△m
80 120 142 58 142-80=62
0.2m y x
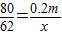 ,
,
解得:x=0.155mg,y=0.3mg,
硫酸镁溶液中所含的水的质量为2mg-0.155mg,
硫酸镁溶液的总质量为(0.3m+2m-0.155m)g,
则硫酸溶液中溶质的质量分数为
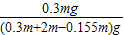 ×100%═13.99%,
×100%═13.99%,答:所加硫酸镁溶液的质量分数13.99%.
(2)因钠离子不参加反应,在整个过程中其数目不随硫酸镁溶液的加入发生变化,即钠离子数目一直不变;
开始溶液中没有硫酸根离子,然后硫酸根离子随硫酸镁溶液的加入在不断增多,但是硫酸根离子浓度是钠离子浓度的一半.开始为氢氧化钠溶液,随硫酸镁溶液的加入,氢氧根离子和镁离子结合生成沉淀,至沉淀最多使氢氧根离子沉淀完全,则氢氧根离子接近为0;故答案为:

点评:本题难度较大,考查有关化学反应方程式的计算,学生应学会利用差量法进行相关计算,并注意在反应中离子是否参加反应来判断离子数目的变化.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目