题目内容
(2006?吉林)实验室现有10%的烧碱溶液和7.3%的盐酸溶液.(1)向一定量的7.3%的盐酸溶液加入等质量的蒸馏水,稀释后的盐酸溶液中的溶质的质量分数为______;
(2)向一定质量的10%的烧碱溶液逐滴滴加溶质质量分数为7.3%的稀盐酸溶液恰好达到中性时,所消耗稀盐酸的质量为100克,求烧碱溶液的质量是多少?
【答案】分析:(1)利用推导结论:加入与溶液等质量的水进行稀释后所得溶液的质量分数为原溶液质量分数的一半,可计算稀释后稀盐酸的质量分数;
(2)根据氢氧化钠与盐酸反应的化学方程式,找出氢氧化钠与HCl的质量关系,利用反应消耗稀盐酸的质量计算所消耗烧碱溶液的质量.
解答:解:(1)根据推导结论,加入与溶液等质量的水进行稀释后所得溶液的质量分数为原溶液质量分数的一半,
加入等质量的蒸馏水,稀释后的盐酸溶液中的溶质的质量分数=7.3%× =3.65%
=3.65%
故答案为:3.65%;
(2)设烧碱溶液的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
x×10% 100g×7.3%
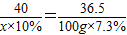
x=80g
答:烧碱溶液的质量是80g.
点评:在使用化学方程式进行计算时,所使用的物质的质量应是纯净物的质量,不可把溶液质量代入进行计算.
(2)根据氢氧化钠与盐酸反应的化学方程式,找出氢氧化钠与HCl的质量关系,利用反应消耗稀盐酸的质量计算所消耗烧碱溶液的质量.
解答:解:(1)根据推导结论,加入与溶液等质量的水进行稀释后所得溶液的质量分数为原溶液质量分数的一半,
加入等质量的蒸馏水,稀释后的盐酸溶液中的溶质的质量分数=7.3%×
 =3.65%
=3.65%故答案为:3.65%;
(2)设烧碱溶液的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
x×10% 100g×7.3%
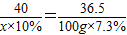
x=80g
答:烧碱溶液的质量是80g.
点评:在使用化学方程式进行计算时,所使用的物质的质量应是纯净物的质量,不可把溶液质量代入进行计算.

练习册系列答案
相关题目