题目内容
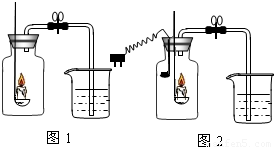
 21、小芳设计实验用蜡烛燃烧法来粗略测定空气中氧气的含量.(如图l装置)
21、小芳设计实验用蜡烛燃烧法来粗略测定空气中氧气的含量.(如图l装置)[活动与探究]
将点燃的蜡烛放入到集气瓶中.当蜡烛熄灭.瓶子冷却到室温时打开弹簧夹,请你推测:她观察到的现象是:进入集气瓶中的水不到集气瓶容积的五分之一.但她发现,观察到的现象与理论值相比偏小.
[猜想与假设]
她对测定值偏小作出以下两个猜想:
猜想一:从蜡烛燃烧的产物中作出猜想.她作出猜想的理由是:反应产生了二氧化碳气体,集气瓶内气体压强减小量不到总压强的五分之一.
猜想二:集气瓶内的氧气没有耗尽.
{方案与验证}
验证猜想一:她对原实验方案进行了改进.将原来瓶内盛装的水改换成了NaOH 溶液;
验证猜想二:他又设计了图2所示实验.在胶塞上同时放置-个下面捆有铁片凹槽的电烙铁.凹槽内放有白磷.待蜡烛熄灭后(蜡烛有剩余).接通电烙铁电源.发现:白磷燃烧,产生大量白烟.由此可以说明:集气瓶内还有氧气.证明猜想二成立.
[反思与评价]通过以上实验给你的启示是:认真观察,不忽视任何可能出现的情况.
[拓展与应用]根据以上图2实验,可以提醒我们可燃物燃烧时,需要满足 与氧气接触这一条件.
分析:本题主要考查如何测定空气中氧气的含量,关键是确定消耗氧气的物质,以及反应后生成物的状态.这就要求所选物质必须能把氧气耗尽,且生成物为固体.
解答:解:[活动与探究]
因为是用蜡烛燃烧消耗氧气,反应生成二氧化碳气体,所以进入集气瓶中的水不到集气瓶容积的五分之一;
猜想一:因为蜡烛燃烧产生气体,所以猜想的理由:反应产生了二氧化碳气体,集气瓶内气体压强减小量不到总压强的五分之一.
猜想二:如果氧气没被耗尽,也会出现结果偏小,所以猜想的理由:集气瓶内的氧气没有耗尽.
验证猜想一:因为氢氧化钠溶液能吸收二氧化碳气体,所以应填:NaOH.
验证猜想二:因为白磷的着火点很低,如果有氧气,稍微加热,白磷就会燃烧,并且白磷燃烧时会产生大量的白烟.所以应填:白磷燃烧,产生大量白烟.集气瓶内还有氧气.
[反思与评价]
实验时,由于药品和条件的不同,可能会出现不同的结果.所以应填:认真观察,不忽视任何可能出现的情况.
[拓展与应用]
要牢固掌握物质燃烧的条件,三个条件同时具备,缺一不可.所以应填:与氧气接触
因为是用蜡烛燃烧消耗氧气,反应生成二氧化碳气体,所以进入集气瓶中的水不到集气瓶容积的五分之一;
猜想一:因为蜡烛燃烧产生气体,所以猜想的理由:反应产生了二氧化碳气体,集气瓶内气体压强减小量不到总压强的五分之一.
猜想二:如果氧气没被耗尽,也会出现结果偏小,所以猜想的理由:集气瓶内的氧气没有耗尽.
验证猜想一:因为氢氧化钠溶液能吸收二氧化碳气体,所以应填:NaOH.
验证猜想二:因为白磷的着火点很低,如果有氧气,稍微加热,白磷就会燃烧,并且白磷燃烧时会产生大量的白烟.所以应填:白磷燃烧,产生大量白烟.集气瓶内还有氧气.
[反思与评价]
实验时,由于药品和条件的不同,可能会出现不同的结果.所以应填:认真观察,不忽视任何可能出现的情况.
[拓展与应用]
要牢固掌握物质燃烧的条件,三个条件同时具备,缺一不可.所以应填:与氧气接触
点评:这道题考查如何选择反应物,并能根据实验过程得出科学的结论.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
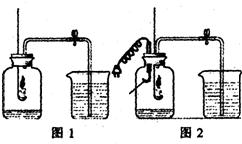
 小明和小芳在讨论“能否用蜡烛燃烧法来粗略测定空气中氧气的含量”这一问题时,小芳认为:通过下图1装置,用蜡烛燃烧法测得空气中氧气的含量会
小明和小芳在讨论“能否用蜡烛燃烧法来粗略测定空气中氧气的含量”这一问题时,小芳认为:通过下图1装置,用蜡烛燃烧法测得空气中氧气的含量会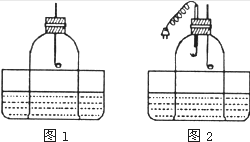 小明和小芳在讨论“能否用蜡烛燃烧法来粗略测定空气中氧气的含量”这一问题时,小芳认为:通过图l装置,用蜡烛燃烧法测得空气中氧气的含量会
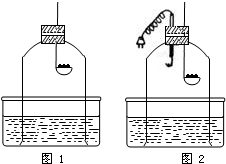
小明和小芳在讨论“能否用蜡烛燃烧法来粗略测定空气中氧气的含量”这一问题时,小芳认为:通过图l装置,用蜡烛燃烧法测得空气中氧气的含量会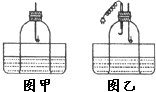 小芳在实验室用蜡烛燃烧法通过下图甲装置来测定空气中氧气的含量,经过多次实验,发现误差仍然很大.你猜想她的实验结论会
小芳在实验室用蜡烛燃烧法通过下图甲装置来测定空气中氧气的含量,经过多次实验,发现误差仍然很大.你猜想她的实验结论会