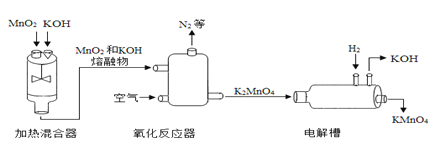
题目内容
【题目】现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下探究。(查阅资料:已知 Ag2SO4微溶于水;AgOH为白色沉淀)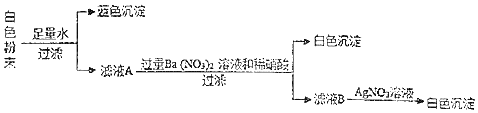
回答下列问题:
(1)生成蓝色沉淀的化学方程式是_____。
(2)加入硝酸钡生成的沉淀是_____(写化学式,下同),加入过量 Ba(NO3)2溶液和稀硝酸的目的是_____。
(3)取少量滤液A,向其中滴加酚酞试液,若发现酚酞变红,结合整个探究过程,则滤液A中一定含有的阴离子是_____(写离子符号)。
【答案】【答题空1】2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 【答题空2】BaSO4 排除硫酸根离子的干扰或排除硫酸根离子和氢氧根离子的干扰 OH﹣、SO42﹣、Cl-
【解析】
(1)白色粉末加足量水生成蓝色沉淀,是因为氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,故填2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,故填BaSO4;加入过量Ba(NO3)2溶液和稀硝酸的目的是排除硫酸根离子的干扰或排除硫酸根离子和氢氧根离子的干扰,故填排除硫酸根离子的干扰或排除硫酸根离子和氢氧根离子的干扰;
(3)取少量滤液A,向其中滴加酚酞试液,若发现酚酞变红,说明溶液中含有OH﹣,在滤液B中加入硝酸银生成氯化银白色沉淀,说明一定有Cl﹣,白色粉末加足量水过滤得到蓝色沉淀,说明滤液中一定含有SO42﹣,故填OH﹣、SO42﹣、Cl-。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目