题目内容
碳和足量的氧气在点燃条件下完全反应生成二氧化碳,每________份质量的碳与________份质量的氧气反应,生成44份质量的二氧化碳;若有6g碳完全燃烧,需要________g氧气,生成________g二氧化碳.
12 32 16 22
分析:根据相对分子质量及质量守恒定律即可得出答案.
解答:碳和足量的氧气在点燃条件下完全反应生成二氧化碳的化学方程式为:C+O2 CO2
CO2
碳的相对分子质量为12,氧气的相对分子质量为32,二氧化碳的相对分子质量为44,故填:12、32;
根据化学方程式,设若有6g碳完全燃烧,则需要氧气的质量为X,生成二氧化碳的质量为Y
C+O2 CO2
CO2
12 32 44
6g X Y
则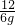 =
=
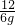 =
=
则X=16g Y=22g
故答案为:12;32;16;22
点评:本题主要考查学生对元素的相对原子质量和化学方程式意义及计算.
分析:根据相对分子质量及质量守恒定律即可得出答案.
解答:碳和足量的氧气在点燃条件下完全反应生成二氧化碳的化学方程式为:C+O2
 CO2
CO2碳的相对分子质量为12,氧气的相对分子质量为32,二氧化碳的相对分子质量为44,故填:12、32;
根据化学方程式,设若有6g碳完全燃烧,则需要氧气的质量为X,生成二氧化碳的质量为Y
C+O2
 CO2
CO212 32 44
6g X Y
则
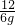 =
=
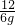 =
=
则X=16g Y=22g
故答案为:12;32;16;22
点评:本题主要考查学生对元素的相对原子质量和化学方程式意义及计算.

练习册系列答案
相关题目
 科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可 以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可 以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象: