题目内容
(12分)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。
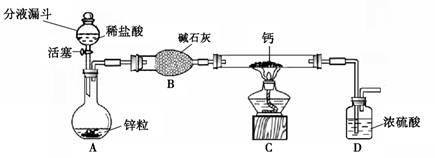
图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为 。(结果精确到0.1%)
⑴ Zn + 2HCl = ZnCl2 + H2↑
⑵ 吸收水蒸气和氯化氢气体
⑶ Ca+H2 △==== CaH2
⑷ 将活塞关闭后,往分液漏斗中加入适量的水,用手指堵住装置D的导管口,打开活塞,若气密性良好,可观察到分液漏斗内的液面几乎不下降(合理答案均可)
⑸ 气泡不再产生(合理答案均可)
⑹ 100.0
⑺ 88.4%
【解析】(1)根据反应装置可知以锌和稀盐酸反应制取氢气,所以化学方程式为:Zn + 2HCl = ZnCl2 + H2↑;(2)在加热氢气时可能会生成水蒸汽,稀盐酸也可能会发,所以氯化钙的作用就是吸收水蒸气和氯化氢气体;(3)根据质量守恒原理写出制取氢化钙的化学方程式为Ca+H2 △==== CaH2;(4)使装置达到密闭,分液漏斗中液面不发生变化,就可说明装置气密性良好;(5)气泡不再产生,说明已完全反应;(6)因为氢气不溶于水

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
