题目内容
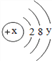
【题目】已知98%浓H2SO4密度为1.84g/cm3,62%浓HNO3密度为1.14g/cm3;若要配制浓H2SO4与浓HNO3的混合溶液,则应将 (填化学式)沿玻璃棒缓慢倒入盛有 (填化学式)的烧杯中,边加边搅拌,冷却后装瓶过程中玻璃棒的作用是 、 .
【答案】浓H2SO4;浓HNO3;引流;搅拌.
【解析】浓硫酸稀释时放热,所以要配制浓H2SO4与浓HNO3的混合溶液,则应将浓H2SO4沿玻璃棒缓慢倒入盛有浓HNO3的烧杯中,边加边搅拌,冷却后装瓶过程中玻璃棒的作用是引流、搅拌.

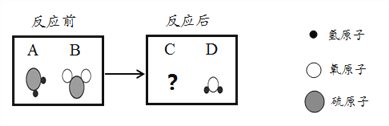
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的符号表达式______________________________;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:_____________________;
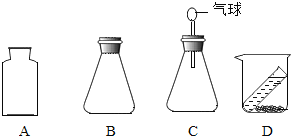
(3)要使该反应能用于验证质量守恒定律,最合理的实验装置是____________(填序号);
(4)小红按右下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
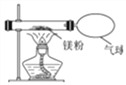
【提出问题】黄色固体是什么?
【查阅资料】(Ⅰ)镁能与二氧化碳反应生成碳和氧化镁;
(Ⅱ)镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;
(Ⅲ)氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】
猜想一:固体是碳;
猜想二:固体是氧化镁
猜想三:黄色固体是Mg3N2
【实验探究】固体不可能是碳和氧化镁,原因①______________________;
请设计实验,验证猜想:
实验操作 | 实验现象 | 结论 | |
取少量固体于试管中,加水;将湿润的红色石蕊试纸放在试管口 | ②________________ | 该固体是Mg3N2 | |
【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:③__________________________________。