题目内容
 元素周期表是学习和研究化学的重要工具.请根据下表回答有关问题:
元素周期表是学习和研究化学的重要工具.请根据下表回答有关问题:| 族 周期 |
I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
( ) P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(2)磷元素一格中,( )内的数字应是
(3)11号元素与17号元素组成的纯净物由
(4)在元素周期表中,同一族的元素具有相似的化学性质,由此可知,同一族的元素原子结构上的共同点是
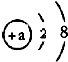
(5)如图为某粒子的结构示意图,结合上表回答:若该粒子是原子,则a=
(2)根据元素周期表是按原子序数递增的顺序排列的,相对原子质量=质子数+中子数,进行分析解答.
(3)11号元素与17号元素分别是钠元素和氯元素,组成的纯净物是氯化钠.
(4)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,进行分析解答.
(5)当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.
(2)元素周期表是按原子序数递增的顺序排列的,磷元素一格中,括号内应填的数字是15;氟原子的原子序数为9,相对分子质量为19.00,根据原子序数=核电荷数=质子数,则该元素的原子核内质子数:19.00-9=10.
(3)11号元素与17号元素分别是钠元素和氯元素,组成的纯净物是氯化钠,氯化钠是由钠离子和氯离子构成的.
(4)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似;在元素周期表中,同一族的元素具有相似的化学性质,由此可知,同一族的元素原子结构上的共同点是最外层电子数相同.
(5)原子中,质子数=核外电子数,则若该粒子是原子,则a=2+8=10;阳离子中,质子数>核外电子数,若该粒子是阳离子,则a的数值≥10,可能11、12或13;若是11,则该离子是钠离子,其离子符号位:Na+.
故答案为:(1)硼元素的原子序数为5等;(2)15;10;(3)离子;(4)最外层电子数相同;(5)10;11等;Na+.

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
|
族
周期 |
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 炭 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:___________________________。
(2)请从上表中找出一种元素名称是错误的,更正为 .
(3)第3周期(横行)中属于金属元素的是 (填一种元素符号),其阳离子是 。
(4)在金属活泼性中,镁元素比铝元素活泼,请你从原子结构的观念进行解释 。
(5)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻, 其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为 。
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
|
|
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息: 。
(2)第3周期中相对原子质量最大的金属元素的是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl
(4)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体和水,该反应的化学方程式为 。