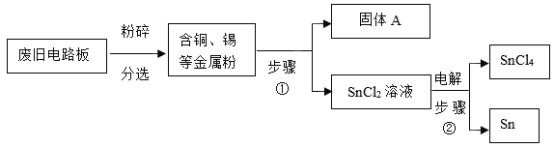
题目内容
有一包白色固体样品,可能含有CaCO3、Na2CO3、CaCl2中的两种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有白色固体剩余。
步骤II:过滤步骤I的混合物,得到滤液和滤渣。
步骤III:取少量滤液于试管中,再加入稀盐酸,有无色气泡产生。
根据上述实验,回答下列问题:
(1)步骤I中的白色固体是_____;步骤III的无色气泡是_____。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是_____。
(3)若要进一步确定样品的组成,还需进行的实验操作是:取少量步骤II的滤液于试管中,_____。
练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下表是几种物质在20℃的溶解度和相对分子质量。回答下列问题:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 9.6 | 37.2 | 21.0 |
相对分子质量 | 58.5 | 84 | 53.5 | 79 |
(1)20℃时,用50g蒸馏水配制饱和NaHCO3溶液。
①计算需称量NaHCO3的质量是_____g。
②将称量的NaHCO3固体倒入盛有50g蒸馏水的烧杯中,然后用_____(填仪器名称)不断搅拌,直至_____。
③用配制所得的溶液可处理溶质的质量分数为1%的稀H2SO4_____g。
(2)相同温度下,不同溶质同时溶解在同一溶剂中,溶解度不变。在20℃时,将11.7gNaCl固体和15.8gNH4HCO3固体同时放入盛有100g水的烧杯中,充分搅拌,静置,观察到烧杯底部有晶体出现,该过程只发生复分解反应。杯底的晶体是_____,杯底晶体的质量是_____g。


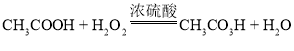 。取质量相等的乙酸(CH3COOH)和50% H2O2溶液均匀混合,再加入适量浓硫酸。一定条件下,测得溶液中过氧乙酸质量分数的数据如图。下列说法不正确的是
。取质量相等的乙酸(CH3COOH)和50% H2O2溶液均匀混合,再加入适量浓硫酸。一定条件下,测得溶液中过氧乙酸质量分数的数据如图。下列说法不正确的是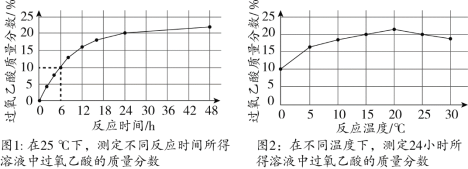
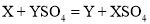
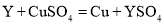
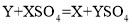
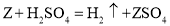

 K2S+N2↑+3CO2↑,下列说法错误的是( )
K2S+N2↑+3CO2↑,下列说法错误的是( ) ×100%
×100%